
【题目】铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:

已知:①4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3![]() 2NaAlO2+CO;
2NaAlO2+CO;
完成下列填空:
(1)操作Ⅰ在常温下该反应速率极慢,下列措施中能使反应速率增大的是____。
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
(2)固体X中主要含有___(填写化学式)。
(3)操作Ⅳ中有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、___、____、洗涤、干燥。
(4)如表是相关物质的溶解度数据,操作Ⅳ中发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,该反应在溶液中能发生的理由是____(文字说明)。
物质 | 溶解度(g/100g水) | ||
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取![]() 样品,加入过量____(填写试剂)、溶解、过滤、再加入(或通入)____(填写试剂)、……灼烧、冷却、称量,得干燥固体
样品,加入过量____(填写试剂)、溶解、过滤、再加入(或通入)____(填写试剂)、……灼烧、冷却、称量,得干燥固体![]() 。计算样品中氢氧化铝的质量分数为___(用含m、n的代数式表示)。
。计算样品中氢氧化铝的质量分数为___(用含m、n的代数式表示)。
【答案】AC Fe2O3、MgO 冷却结晶 过滤 K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小) NaOH溶液 过量二氧化碳 ![]()
【解析】
铬铁矿的主要成分可表示为FeOCr2O3,还含有MgO、Al2O3、Fe2O3等杂质,因此加入氧气和碳酸钠发生反应①和②,氧化铁、氧化铝不溶于水,操作Ⅰ是过滤,因此得到固体X为Fe2O3、MgO,酸化步骤用酸调节溶液pH<5,依据流程图中物质的转化和制备目的可知所以目的是使CrO42-转化为Cr2O72-,之后根据物质的溶解度大小,从溶液蒸发浓缩、冷却结晶、过滤,将得到的晶体洗涤干燥即可得到晶体。根据此分析进行解答。
(1)增大反应速率可以升高温度或将原料进行粉碎,增大反映的接触面积。
故答案选A C
(2)由反应可知氧化铁、氧化铝不溶于水,操作Ⅰ是过滤,因此得到固体X为Fe2O3、MgO。
故答案为Fe2O3 MgO
(3)利用溶解度得到晶体的一般步骤为:蒸发浓缩、冷却结晶、过滤,将得到的晶体洗涤干燥即可得到晶体。
故答案为 冷却结晶 过滤
(4)由表格数据可看出K2Cr2O7的溶解度很低,是四个物质中最低的,利用溶解度小可以获得K2Cr2O7的晶体。
故答案为 K2Cr2O7的溶解度比K2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小)
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,利用氢氧化铝的两性,加入过量NaOH溶液后过滤,得到四羟基合铝酸钠溶液,再加入CO2,灼烧、冷却得到Al2O3固体,根据铝元素守恒可得氢氧化铝的质量分数=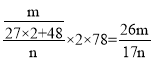 。
。
故答案为![]()


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】香豆素是一种天然香料,存在于黑香豆、兰花等植物中。工业上常用水杨醛与乙酸酐在催化剂存在下加热反应制得:
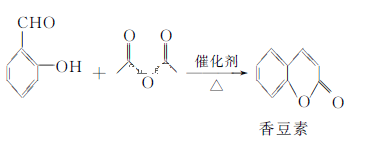
以下是由甲苯为原料生产香豆素的一种合成路线(部分反应条件及副产物已略去):
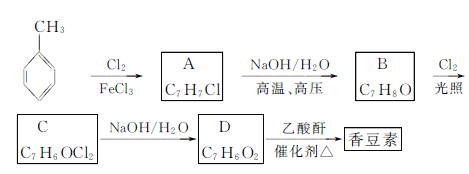
已知以下信息:
①A中有五种不同化学环境的氢;
②B可与FeCl3溶液发生显色反应;
③同一个碳原子上连有两个羟基通常不稳定,易脱水形成羰基。
请回答下列问题:
(1)香豆素的分子式为____________;
(2)由甲苯生成A的反应类型为________,A的化学名称为________;
(3)由B生成C的化学反应方程式为____________;
(4)B的同分异构体中含有苯环的还有________种,其中在核磁共振氢谱中只出现四组峰的有________种;
(5)D的同分异构体中含有苯环的还有________种,其中:
①既能发生银镜反应,又能发生水解反应的是____________(写结构简式);
②能够与饱和碳酸氢钠溶液反应放出CO2的是____________(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从废铅蓄电池铅膏(含PbSO4、PbO2和Pb等)中回收铅的一种工艺流程如下:

已知:浓硫酸不与PbO2反应,Ksp(PbCl2)=2.0×10-5,Ksp(PbSO4)=1.5×10-8,PbCl2(s)+2Cl-(aq)=PbCl42-(aq)。下列说法错误的是
A. 合理处理废铅蓄电池有利于资源再利用和防止重金属污染
B. 步骤①中可用浓硫酸代替浓盐酸
C. 步骤①、②、③中均涉及过滤操作
D. PbSO4(s)+2Cl-(aq)![]() PbCl2(s)+SO42-(aq)的平衡常数为7.5×10-4
PbCl2(s)+SO42-(aq)的平衡常数为7.5×10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所示物质的制备方法合理的是
A.实验室从海帶中提取单质碘取样→灼烧→溶解→过滤→萃取→蒸馏
B.金红石(主要成分TiO2)为原料生产金属Ti:金红石、焦炭![]() TiCl4
TiCl4![]() Ti
Ti
C.从卤水中(溶质主要是MgCl2)提取Mg:卤水![]() Mg(OH)2
Mg(OH)2![]() MgCl2(aq)
MgCl2(aq) ![]() MgCl2(s)
MgCl2(s) ![]() Mg
Mg
D.由食盐制取漂粉精NaCl(ag) ![]() Cl2
Cl2![]() 漂粉精
漂粉精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要配制480mL0.1mol·L-1Na2CO3溶液,回答下列问题。
(1)应用托盘天平称取Na2CO3·10H2O晶体___g。
(2)配制Na2CO3溶液时需用的主要玻璃仪器有烧杯、玻璃棒、___、___。
(3)若实验遇下列情况,溶液的浓度偏低的是___
A.加水时超过刻度线
B.忘记将洗涤液加入容量瓶
C.容量瓶内壁附有水珠而未进行干燥处理
D.定容后摇匀,液面低于刻度线
E.称量时砝码生锈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 硅酸钠溶液与盐酸的反应:Na2SiO3+2H+===H2SiO3↓+2Na+
B. 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O===3I2+6OH-
C. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
D. 向NaHCO3溶液中滴加少量Ba(OH)2溶液:Ba2++OH-+HCO3—===BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将红热的固体单质甲放入显黄色的浓乙溶液中,剧烈反应,产生混合气体A,A在常温下不与空气作用,发生如下图所示的变化。

则:①写出下列物质的化学式:
丙__________,B____________,C__________, D____________。
②写出甲跟乙反应的化学方程式:__________________________。
③单质丙与溶液乙反应生成气体B的离子方程式:___________________。
(2)如图是各物质的反应关系图:已知A和E都是黄色粉末,F有刺激性气味且有漂白性。请据此回答下列问题:
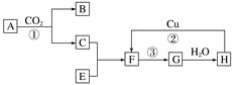
写出图中编号的化学方程式:
①_______________________;
②_______________________;
③______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组以菱铁矿(主要成分为FeCO3,含有SiO2、Al2O3等少量杂质)为原料制备氯化铁晶体(FeCl3·6H2O)的实验过程如下:

(1)酸溶及后续过程中均需保持算过量,其目的除了提高铁元素的浸出率之外,还有___________。
(2)操作Ⅰ名称是_______________。
(3)滴加H2O2溶液氧化时,发生主要反应的离子方程式为_________________。
(4)在氧化过程中,如何检验铁元素全部以Fe3+形式存在:_______________________。
(5)加入过量NaOH溶液的目的是__________________。
(6)请补充完整由过滤后得到的固体制备FeCl3·6H2O的实验方案:向过滤后所得固体______,用水洗涤固体2-3次,低温干燥,得到FeCl3·6H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化a mol/L FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测合理的是
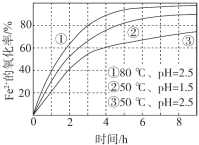
A. 由①、②可知, pH越大,+2价铁越易被氧化
B. 由②、③推测,若pH>7,+2价铁更难被氧化
C. 由①、③推测,FeCl2被O2氧化的反应为放热反应
D. 60℃、pH=2.5时, 4 h内Fe2+的平均消耗速率大于 0.15a mol/(L·h)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com