
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是
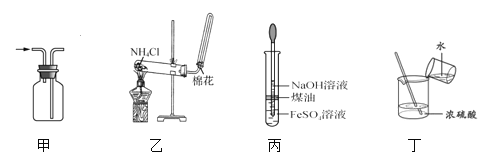
A. 用图甲所示装置收集 NO B. 用图乙所示装置制备 NH3
C. 用图丙所示装置制备 Fe(OH)2 D. 用图丁所示装置稀释浓 H2SO4
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】纯二氧化硅可用下列流程制得。下列说法不正确的是
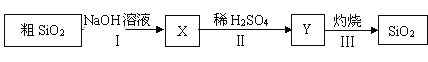
A. X可用作木材防火剂
B. 步骤Ⅱ中的稀硫酸可用CO2来代替
C. 步骤II的反应是Na2SiO3+ H2SO4 = H2SiO3(胶体) + Na2SO4
D. 步骤 Ⅲ若在实验室完成,一般在蒸发皿中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol 电子
3H2+CO,每消耗1molCH4转移12mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯吡格雷是一种用于预防和治疗因血小板高聚集引起的心、脑及其他动脉循环障碍疾 病的药物。以2氯苯甲醛为原料合成该药物的路线如下:

(1)A中官能团名称为_____,A发生银镜反应的化学方程式为_____。
(2)C生成D的反应类型为_____。
(3)X(C6H7BrS)的结构简式为_____。
(4)写出C聚合成高分子化合物的化学反应方程式:_____。
(5)物质G是物质A的同系物,比A多一个碳原子,符合以下条件的G的同分异构体共有______种。
①除苯环之外无其他环状结构;②能发生银镜反应。 其中核磁共振氢谱中有5个吸收峰,且峰值比为2∶2∶1∶1∶1的结构简式为_____。
(6)已知: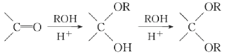 ,写出以乙烯、甲醇为有机原料制备化 合物
,写出以乙烯、甲醇为有机原料制备化 合物![]() 的合成路线(无机试剂任选)__________
的合成路线(无机试剂任选)__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为 3.8 ℃,42 ℃以上会分解生成 Cl2 和 O2,Cl2O 易溶于水并与水反应生成 HClO。
(制备产品)
将氯气和空气(不参与反应)按体积比 1∶3 混合通入含水 8%的碳酸钠中制备 Cl2O,并 用水吸收 Cl2O(不含 Cl2)制备次氯酸溶液。

(1)各装置的连接顺序为 → → →C→ 。_____
(2)写出 A 中反应的离子方程式______。
(3)装置 B 中多孔球泡和搅拌棒的作用是_________; 装置 C 的作用是_____。
(4)制备 Cl2O 的化学方程式为_____。
(5)反应过程中,装置 B 需放在冷水中,其目的是_____。
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液有两个主要优点,分别是_____、_____。
(测定浓度)
(7)用下列实验方案测定装置 E 所得溶液中次氯酸的物质的量浓度:
量取 10.00 mL 上述次氯酸溶液,并稀释至 100.00 mL,再从其中取出 10.00 mL 于 锥形瓶中,并加入 10.00 mL 0.8000 mol·L-1 的 FeSO4 溶液(过量),充分反应后,用0.05000 mol·L-1 的酸性 KMnO4 溶液滴定剩余的 Fe2+,消耗 KMnO4 溶液 24.00 mL,则 原次氯酸溶液的浓度为_____。判断下列情况对 HClO 含量测定结果的影响(填“偏高” 、“偏低”或“无影响 ”)若 FeSO4 标准溶液部分变质,会使测定结果_____;若配制酸性 KMnO4 溶液 时,定容时俯视刻度线,会使测定结果_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应可用于焊接钢轨,反应为:2Al + Fe2O3 ![]() 2Fe + Al2O3,下列关于该反应说法正确的是
2Fe + Al2O3,下列关于该反应说法正确的是
A. Al 是还原剂 B. Fe2O3 发生氧化反应
C. Fe 是氧化产物 D. 当生成 1 mol Fe 时,转移 6 mol 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G七种短周期主族元素,它们的原子序数依次增大。B原子的最外层电子数是其次外层电子数的2倍。A的一种原子中,中子数为零。D元素原子的最外层电子数为m=6,次外层电子数为n。E元素原子的L层上电子数为(m+n),M层上电子数为(m/2-n)。F与D同主族。请回答下列问题:
(1)B元素在周期表中的位置是_____,G的离子结构示意图为______
(2)F与G最高价氧化物的水化物的酸性强弱为______>_____(填化学式)
(3)简单D离子和E离子的半径由大到小______>______(填离子符号)
(4)B和D简单气态氢化物的稳定性强弱为_____<_______(填化学式)
(5)F的一种氧化物中氧的质量分数为50%,写出该氧化物与G单质水溶液反应的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上运用电化学方法降解含NO3-废水的原理如图所示,下列有关说法不正确的是

A. 相同条件下,Pt电极上产生O2和Pt-A电极上产生N2的体积比为5:2
B. 通电时电子的流向:b电极→导线→Pt-Ag电极→溶液→Pt电极→导线→a极
C. Pt-Ag电极上的电极反应式:2NO3-+12H++10e-=N2+6H2O
D. 通电时,Pt电极附近溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下表标出的是元素周期表的一部分元素,回答下列问题:
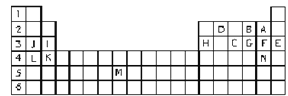
①表中用字母标出的14种元素中,化学性质最不活泼的是____________(用元素符号表示,下同),金属性最强的是____________,常温下单质为液态的非金属元素是____________。
②B、F、C气态氢化物中以________(填分子式)最不稳定。
Ⅱ. 有短周期的A、B、C、D、E 五种元素,它们在周期表的位置如图所示。已知A原子最外层电子数是次外层电子数的2倍。试回答下列问题:
![]()
(1) 元素E在周期表中位于第_______周期_______族。
(2) 元素A的最高价氧化物的电子式为________,元素D的原子结构示意图为________;
(3) 比较C、D两种元素最高价氧化物对应水化物的酸性强弱:______ > ______。(用分子式表示)
(4)元素C的气态氢化物与元素E的最高价氧化物对应水化物化合生成的正盐的化学式为___________,该盐的晶体类型为________。
(5) ①元素B所在周期的简单离子半径最小的是______。(用离子符号表示)
②元素C、D的简单氢化物沸点较高的是______。(用分子式表示)
(6)请用电子式表示Na2S的形成过程____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com