
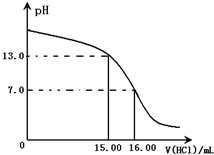
 Ⅰ.某研究性学习小组用一定物质的量浓度的盐酸滴定10.00mL某浓度的NaOH溶液,滴定时使用pH计精确测量滴定过程中溶液的pH变化(温度为25℃),并绘制出滴定过程中溶液pH的变化曲线(如图).
Ⅰ.某研究性学习小组用一定物质的量浓度的盐酸滴定10.00mL某浓度的NaOH溶液,滴定时使用pH计精确测量滴定过程中溶液的pH变化(温度为25℃),并绘制出滴定过程中溶液pH的变化曲线(如图).| 实验步骤 | 设计这一步骤的目的 |
| (1)将配制的氢氧化钠溶液加热 | ① |
| (2)在加热后的溶液中滴加酚酞,并在上方滴一些植物油 | ②利用植物油隔绝空气 |
| 实验方法 | 观察到的现象 | 结论 |
| 方案一:分别配制不同物质的量浓度的氢氧化钠溶液,然后各滴加数滴酚酞溶液. | 浓度大的溶液中红色会消失 | 红色消失与氢氧化钠溶液的浓度大小有关 |
| 方案二:向原红色消失的溶液中加 ①(填试剂名称) | ② |
分析 Ⅰ.设NaOH溶液、盐酸的浓度,然后根据滴定曲线立方程式组来求解;
Ⅱ.(1)如果“可能是氢氧化钠溶液与空气中二氧化碳反应的缘故”,而碳酸钠溶液显碱性,也可使酚酞试剂变红;
(2)①为排除“可能是酚酞与空气中氧气反应,使红色消失的缘故”,避免氢氧化钠溶液中出现氧气或空气,实验中“加热”目的是:赶走溶液中少量氧气,“滴入植物油”目的是:隔绝氧气;
(3)如果“可能与氢氧化钠溶液浓度的大小有关”,方案二:向原红色消失的溶液中加,加水稀释溶液变红,则说明红色消失与氢氧化钠溶液浓度大小有关.
解答 解:(1)设NaOH溶液、盐酸的浓度分别为Y mol/L,Xmol/L;
盐酸滴入的体积为20mL时有:10mL×Y mol/L-15.00mL×Xmol/L=25.00mL×10-1mol/L;
盐酸滴入的体积为16mL时有:16mL×Xmol/L=10mL×Ymol/L;
解得:X=2.5;Y=4
故答案为:4.0mol/L;
Ⅱ.(1)如果“可能是氢氧化钠溶液与空气中二氧化碳反应的缘故”,而碳酸钠溶液显碱性,也可使酚酞试剂变红,
故答案为:NaOH与空气中的CO2反应后的产物是碳酸钠,碳酸钠溶液显碱性,也可使酚酞试剂变红;
(2)①实验中“加热”目的是:赶走溶液中少量氧气,避免氢氧化钠溶液中出现氧气或空气,
故答案为:除去溶液的氧气;
(3)向原红色消失的溶液中加,加水稀释溶液变红,则说明红色消失与氢氧化钠溶液浓度大小有关;
故答案为:①水;②红色重新出现,则说明红色消失与氢氧化钠溶液浓度大小有关.
点评 本题考查了如何探究物质的性质和变化规律,掌握反应现象与本质的联系、学会猜想和事实验证的方法是解题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
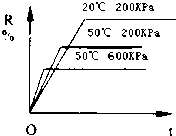 在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2L(?),该反应中R的百分含量在不同条件下的变化如下图所示,请判断下列结论正确的是( )
在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2L(?),该反应中R的百分含量在不同条件下的变化如下图所示,请判断下列结论正确的是( )| A. | 正反应为放热反应,L为气体 | B. | 正反应为吸热反应,L为气体 | ||
| C. | 正反应为吸热反应,L为固体或液体 | D. | 正反应为放热反应,L为固体或液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物全部转化为甲醇 | |
| B. | 正反应和逆反应的化学反应速率均为零 | |
| C. | 反应体系中甲醇的百分含量不再变化 | |
| D. | CO和H2以1:1的物质的量之比反应生成甲醉 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应及平衡常数 | 平衡常数数值 | ||
| 500℃ | 800℃ | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | 2.5 | 0.375 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com