
 亚硝酸(HNO2)是一元弱酸,亚硝酸及其盐在实验和工业生产中有重要应用.请回答:
亚硝酸(HNO2)是一元弱酸,亚硝酸及其盐在实验和工业生产中有重要应用.请回答:分析 (1)亚硝酸(HNO2)是一元弱酸,溶液中存在电离平衡,电离平衡常数等于生成离子浓度幂之积与反应物浓度幂之积的比;
(2)Cr2O72-的处于高价态化合价降低被还原生成三价铬离子,NO2-的氮元素化合价升高,被氧化生成硝酸根离子,依据氧化还原反应化合价升降数目相等结合原子个数守恒配平方程式;
(3)①M点对应溶液中,c(OH-)=c(H+)+c(HNO2),说明该点溶液中溶质为NaNO2,二者恰好完全反应,二者的物质的量相等;
②N点溶液呈中性,说明溶液中c(OH-)=c(H+),
A.亚硝酸钠是强碱弱酸盐,其水溶液呈碱性,要使混合溶液呈中性,则亚硝酸应该稍微过量;
B.常温下,该溶液呈中性,则水电离出来的c(H+)=1×10-7 mol•L-1;
C.根据电荷守恒判断c(Na+)、c(NO2-)相对大小;
D.溶液中水的电离程度很小,但钠离子浓度较大.
解答 解:(1)亚硝酸(HNO2)是一元弱酸,溶液中存在电离平衡,HNO2?H++NO2-,电离平衡常数Ka=$\frac{c(N{{O}_{2}}^{-})c({H}^{+})}{c(HN{O}_{2})}$,故答案为:$\frac{c(N{{O}_{2}}^{-})c({H}^{+})}{c(HN{O}_{2})}$;
(2)Cr2O72-的处于高价态化合价降低被还原生成三价铬离子,NO2-的氮元素化合价升高,被氧化生成硝酸根离子,1个Cr2O72-降低6价,一个NO2-被氧化为硝酸根离子,化合价升2价,依据氧化还原反应化合价升降数目相等,Cr2O72-系数为1,亚硝酸根离子系数为3,依据原子个数守恒,反应的方程式为:Cr2O72-+3NO2-+8H+═2Cr3++3NO3-+4H2O,
故答案为:Cr2O72-+3NO2-+8H+═2Cr3++3NO3-+4H2O;
(3)①M点对应溶液中,c(OH-)=c(H+)+c(HNO2),说明该点溶液中溶质为NaNO2,二者恰好完全反应,二者的物质的量相等,则c(HNO2)•v(HNO2)=c(NaOH)•v(NaOH)
所以c(HNO2)=$\frac{0.100mol/L×0.022L}{0.020L}$=0.110mol/L,
故答案为:0.110mol/L;
②N点溶液呈中性,说明溶液中c(OH-)=c(H+),
A.亚硝酸钠是强碱弱酸盐,其水溶液呈碱性,要使混合溶液呈中性,则亚硝酸应该稍微过量,则溶液中的溶质为亚硝酸钠和亚硝酸,故A错误;
B.常温下,该溶液呈中性,则水电离出来的c(H+)=1×10-7 mol•L-1,故B正确;
C.溶液中c(OH-)=c(H+),根据电荷守恒得c(Na+)=c(NO2-),故C正确;
D.溶液中水的电离程度很小,但钠离子浓度较大,所以c(Na+)>c(OH-),故D错误;
故选BC.
点评 本题考查弱电解质的电离及酸碱混合溶液定性判断等知识点,为高频考点,侧重考查学生图象分析、判断能力,正确判断(3)题图中M、N点溶液中溶质成分是解本题关键,易错点是利用M点质子守恒确定M点溶质成分,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②⑤⑥⑧ | C. | ②⑦⑧ | D. | ③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量使用含磷洗涤剂会引发潮汐 | |
| B. | 减少使用氟氯代烃的目的是减少酸雨 | |
| C. | 大量开采地下水,矿产资源,以满足社会经济发展的需求 | |
| D. | 氢燃料电池汽车的使用,可以有效减少城市空气污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL pH=13的氨水与10mL pH=l的盐酸混合:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | l0 mL0.1 mol/L NH4Cl溶液与5mL 0.2mol/LNaOH溶液混合:c(Cl-)=c(Na+)>c(OH-)>(H+) | |
| C. | 10 mL 0.1 mol/L CH3COOH溶液与10 mL pH=13的NaOH溶液混合:c(CH3COO-)=c(Na+)>c(OH-)>c(H+) | |
| D. | l0 mL 0.5mol/L CH3COONa溶液与6mL pH=0的盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 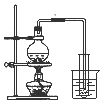 制取少量蒸馏水 | B. |  制取少量NO2 | ||
| C. | 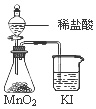 比较MnO2、Cl2、I2的氧化性 | D. |  量取8.50mL的 稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在c(CO32-)=0.1 mol•L-1的溶液中:K+、AlO2-、Cl-、NO3- | |
| B. | 在常温下由水电离出的c(OH-)=1×10-12 mol•L-1的溶液中:Fe2+、ClO-、Na+、SO42- | |
| C. | 在加入苯酚会显紫色的溶液中:NH4+、Cl-、Na+、SCN- | |
| D. | 在能使蓝色石蕊试纸变红的溶液中:S2O32-、CO32-、Na+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向100mL 0.01mol•L-1的HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH的变化情况,下列说法正确的是( )
常温下,向100mL 0.01mol•L-1的HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH的变化情况,下列说法正确的是( )| A. | HA为弱酸 | |
| B. | 常温下,MA溶液的pH>7 | |
| C. | K点对应的溶液中:c(M+)+c(MOH)=c(A-) | |
| D. | 在N到K间任意一点对应的溶液中:c(M+)+c(H+)=c(OH-)+c(A-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com