
【题目】下列用品与有效成分、用途对应不正确的是( )
A | B | C | D | |
用品 | 漂白液 | 胃舒平 | 熟石灰 | 食盐 |
有效成分 | NaClO | Al(OH)3 | CaO | NaCl |
用途 | 消毒剂 | 抗酸药 | 改良酸性土壤 | 调味品 |
A.AB.BC.CD.D
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液,有关粒子的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。下列说法正确的是

A. M点溶液中:2c(HA-)+c(A2-)=0.2 mol/L
B. N点溶液呈酸性,则c(Na+) < 3c(HA-)
C. 若N点溶液pH =4.2,则Ka2(H2A)的数量级为104
D. V(NaOH)=20mL时,溶液中:c(H+) < c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用0.1000 mol·L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,反应离子方程式是:2MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O
填空完成问题:
(1)该滴定实验所需的玻璃仪器有______________。(填字母)
A.酸式滴定管B.碱式滴定管 C.量筒 D.锥形瓶 E.铁架台F.滴定管夹G.烧杯H.白纸 I.漏斗
(2)不用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因___________________________________________。
(3)滴定终点的现象为___________________________________。
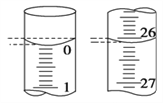
(4)若滴定开始和结束时,滴定管中的液面如图所示,则起始读数为________mL,终点读数为________mL。
(5)某学生根据3次实验分别记录有关数据如下表:
滴定 次数 | 待测H2C2O4溶液的体积/mL | 0.1000 mol/L KMnO4的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该H2C2O4溶液的物质的量浓度为_______________。
(6)下列操作中可能使测定结果偏低的是___________(填字母)。
A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下图两种化合物的结构或性质描述正确的是( )
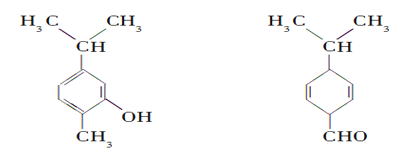
A. 不是同分异构体
B. 分子中共平面的碳原子数相同
C. 均能与溴水反应
D. 可用红外光谱区分,但不能用核磁共振氢谱区分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. Fe与稀硫酸反应:2Fe+6H+=Fe3++3H2↑
B. Cu与AgNO3溶液反应:Cu+2Ag+=Cu2++2Ag
C. 向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D. 向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,22.4LH2O所含的分子数为NA
B.14g氮气所含的氮原子数为NA
C.标准状况下,22.4LNH3所含的电子数为NA
D.1molNa与Cl2反应转移电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100℃时,将0.100mol N2O4气体充入1L恒容抽空的密闭容器中,发生反应:N2O4(g)![]() 2NO2(g)。隔一定时间对该容器内物质的浓度进行分析得到如表数据。回答有关问题;
2NO2(g)。隔一定时间对该容器内物质的浓度进行分析得到如表数据。回答有关问题;
时间(s) | 0 | 20 | 40 | 60 | 80 |
c(N2O4)/mol·L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
c(NO2)/mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
①c3________c4(填“>”、“<”或“=”)。
②在上述条件下,从反应开始直至达到化学平衡时,N2O4的平均反应速率为_________mol·L-1·s-1。
③达平衡后下列条件的改变可使NO2气体浓度增大的是_______(填序号)。
A.扩大容器的容积 B.再充入一定量的N2O4
C.分离出一定量的NO2 D.再充入一定量的He
④若在相同条件下,起始时只充入0.200 mol NO2气体,则达到平衡时NO2气体的转化率为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com