
【题目】在100℃时,将0.100mol N2O4气体充入1L恒容抽空的密闭容器中,发生反应:N2O4(g)![]() 2NO2(g)。隔一定时间对该容器内物质的浓度进行分析得到如表数据。回答有关问题;
2NO2(g)。隔一定时间对该容器内物质的浓度进行分析得到如表数据。回答有关问题;
时间(s) | 0 | 20 | 40 | 60 | 80 |
c(N2O4)/mol·L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
c(NO2)/mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
①c3________c4(填“>”、“<”或“=”)。
②在上述条件下,从反应开始直至达到化学平衡时,N2O4的平均反应速率为_________mol·L-1·s-1。
③达平衡后下列条件的改变可使NO2气体浓度增大的是_______(填序号)。
A.扩大容器的容积 B.再充入一定量的N2O4
C.分离出一定量的NO2 D.再充入一定量的He
④若在相同条件下,起始时只充入0.200 mol NO2气体,则达到平衡时NO2气体的转化率为_________。
【答案】 = 0.001 B 25%
【解析】(1)由表可以知道,![]() 时反应达平衡,此时c(NO2)= 0.120mol·L-1,c(N2O4)= c3mol·L-1,相同温度下,到80s时c(NO2)= 0.120mol·L-1,c(N2O4)= c4 mol·L-1,所以①c3=c4。答案:= 。
时反应达平衡,此时c(NO2)= 0.120mol·L-1,c(N2O4)= c3mol·L-1,相同温度下,到80s时c(NO2)= 0.120mol·L-1,c(N2O4)= c4 mol·L-1,所以①c3=c4。答案:= 。
②在上述条件下,从反应开始直至达到化学平衡时,
N2O4(g) ![]() 2NO2(g)。
2NO2(g)。
初始量 0.100mol/L 0
变化量 0.06 mol/L 0.120mol·L-1
N2O4的平均反应速率为=0.06 mol/L![]() 60S= 0.001 mol·L-1·s-1。答案:0.001
60S= 0.001 mol·L-1·s-1。答案:0.001
③N2O4(g) ![]() 2NO2(g)反应是气体体积减小的放热反应,根据化学平衡原理分析选项,增大二氧化氮浓度的条件;A、增大容器体积,各组分浓度均减小,故A错误;B、再充入四氧化二氮,平衡正向移动,二氧化氮浓度增大,所以B选项是正确的;C、减小NO2的浓度,平衡虽正向进行,但二氧化氮的浓度减小,故C错误;D、再充入一定量的He,总压增大,气体分压不变,平衡不变,二氧化氮浓度不变,故D错误;所以B选项是正确的。
2NO2(g)反应是气体体积减小的放热反应,根据化学平衡原理分析选项,增大二氧化氮浓度的条件;A、增大容器体积,各组分浓度均减小,故A错误;B、再充入四氧化二氮,平衡正向移动,二氧化氮浓度增大,所以B选项是正确的;C、减小NO2的浓度,平衡虽正向进行,但二氧化氮的浓度减小,故C错误;D、再充入一定量的He,总压增大,气体分压不变,平衡不变,二氧化氮浓度不变,故D错误;所以B选项是正确的。
④根据平衡浓度计算平衡常数,结合化学平衡三段式列式计算;
N2O4(g) ![]() 2NO2(g)
2NO2(g)
起始量![]() 0
0
变化量![]() 0.12
0.12
平衡量![]() 0.12
0.12![]()
若起始时充入0.200 mol/L NO2气体,设消耗二氧化氮物质的量浓度为x,
2NO2(g) ![]() N2O4(g) K=1/0.36,
N2O4(g) K=1/0.36,
起始量 0.200 mol/L 0
变化量 x 0.5x
平衡量 0.200 –x 0.5x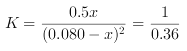 k=0.5x/(0.200 –x)2=1/0.36,
k=0.5x/(0.200 –x)2=1/0.36,
x=0.05 mol/L
则达到平衡时NO2气体的转化率0.05 mol/L /0.2 mol/L ![]() 100%=25%,
100%=25%,
因此,本题正确答案是: 25%.


科目:高中化学 来源: 题型:
【题目】下列用品与有效成分、用途对应不正确的是( )
A | B | C | D | |
用品 | 漂白液 | 胃舒平 | 熟石灰 | 食盐 |
有效成分 | NaClO | Al(OH)3 | CaO | NaCl |
用途 | 消毒剂 | 抗酸药 | 改良酸性土壤 | 调味品 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸试剂瓶标签上的内容如图所示:

(1)该硫酸的物质的量浓度是____________mol/L;
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要240mL 4.6mol.L-1的稀硫酸,则配制稀硫酸时需要取____mL的该硫酸;配制时需选用的仪器主要有量筒、烧杯、玻璃棒、_______、胶头滴管(在横线上填写所缺仪器的名称)。
(3)配制过程中,下列操作会使配制的稀硫酸溶液浓度偏高的是____(填序号)。
①量取浓硫酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液并定容
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表所示。
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表所示。
t ℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_______________。
(2)该反应为________反应(填“吸热”或“放热”)。
(3)某温度下,各物质平衡浓度符合:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为______。
(4)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡____________移动(填“向正反应方向”“向逆反应方向”或“不”)。
(5)若1 200 ℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为____(填“正反应方向”“逆反应方向”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,甲、乙、丙分别表示在不同条件下可逆反应:A(g)+B(g) ![]() xC(g)的生成物 C在反应混合物中的体积分数和反应时间的关系。
xC(g)的生成物 C在反应混合物中的体积分数和反应时间的关系。
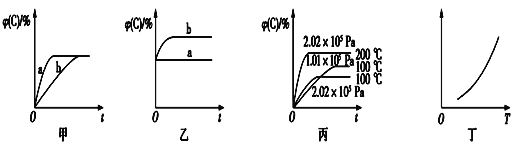
(1)若甲图中两条曲线分别代表有催化剂和无催化剂的情况,则__曲线表示无催化剂时的情况。
(2)若乙图表示反应达到平衡后,分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入氦气后的情况,则__曲线表示恒温恒容的情况。
(3)根据丙图可以判断该可逆反应的正反应是____(填“放热”或“吸热”)反应,化学计量数x的值(或取值范围)是______。
(4)丁图表示在某固定容积的密闭容器中,上述可逆反应达到平衡后,某物理量随着温度(T)的变化情况,根据你的理解,丁图的纵轴可以是________。(填序号)
①φ(C)/% ②A的转化率 ③B的转化率 ④压强 ⑤c(A) ⑥c(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1是细胞中3种化合物含量的扇形图,图2是活细胞中元素含量的柱形图,下列叙述不正确的是( )
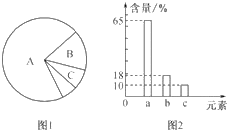
A. 图2中数量最多的元素是碳元素,这与细胞中含量最多的化合物有关
B. 若图1表示正常细胞,则B化合物具有多样性,其必含的元素为C、H、O、N
C. 若图1表示正常细胞,则A、B化合物共有的元素中含量最多的是图2中的a
D. 若图1表示细胞干重中化合物含量的扇形图,则 A化合物中含量最多的元素为图2中的b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 物质的量浓度为0.5 mol/L的MgCl2溶液,含有Cl- 个数为NA
B. V mL硫酸铁溶液中含有mg SO42-,则Fe3+的物质的量浓度为6.94m/V mol·L-1
C. 将58.5 g NaCl溶解于1 L水中配成溶液,所得溶液的物质的量浓度为1 mol·L-1
D. 18g H2O含有8NA个质子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com