
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A. 常温常压下,124 g P4中所含P—P键数目为4NA
B. 22.4 L(标准状况)NH3含有的质子数为18NA
C. 常温常压下,16 g O2和O3混合物中含氧原子数目为NA
D. 密闭容器中,2 mol SO2和1 mol O2充分反应后分子总数为2NA
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】在t ℃时将a g NH3完全溶于水得到V mL溶液,该溶液的密度为ρg·cm-3,质量分数为w。下列说法正确的是
A. 溶质的质量分数w=a/(Vρ-a)×100%
B. 溶质的物质的量浓度c= a/17V mol·L-1
C. 溶液密度ρ可表示为 17c/w g·cm-3
D. 上述溶液中再加入V mL水,所得溶液溶质的质量分数小于0.5w
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )


A. ①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0
B. ②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
C. ③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D. ④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学键的下列叙述中,正确的是( )
A.原子或离子间相互的吸引力叫化学键
B.共价化合物可能含离子键,离子化合物中只含离子键
C.构成单质分子的微粒一定含有共价键
D.共价化合物内部可能有极性键和非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
(1)铜或铜盐的焰色反应为绿色,下列有关原理分析的叙述正确的是_____(填字母)。
a.电子从基态跃迁到较高的激发态 b.电子从较高的激发态跃迁到基态
c.焰色反应的光谱属于吸收光谱 d.焰色反应的光谱属于发射光谱
(2)基态Cu原子中,核外电子占据的最高能层符号是_____,其核外电子排布式中未成对电子数为______个,Cu与Ag均属于IB族,熔点:Cu____Ag(填“>”或“<”)。
(3)[Cu(NH3)4]SO4中阴离子的立体构型是_________;中心原子的轨道杂化类型为__________,[Cu(NH3)4]SO4中Cu2+与NH3之间形成的化学键称为________________。
(4)用Cu作催化剂可以氧化乙醇生成乙醛,乙醛中σ键和π键的比值为___________。
(5)碘、铜两种元素的电负性如表:
元素 | I | Cu |
电负性 | 2.5 | 1.9 |
CuI属于_______(填“共价”或“离子”)化合物。
(6)Cu与Cl形成某种化合物的晶胞如图所示,该晶体的密度为ρg·cm-3,晶胞边长为acm,则阿伏加德罗常数为__________(用含ρ、a的代数式表示)。
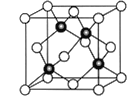
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5 μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5 、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH | SO | NO | Cl- |
浓度(mol·L-1) | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断PM2.5试样的pH=_____________。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+![]() O2(g) = H2O(g) ΔH=-241.8 kJ·mol-1
O2(g) = H2O(g) ΔH=-241.8 kJ·mol-1
C(s)+![]() O2(g) = CO(g) ΔH=-110.5 kJ·mol-1
O2(g) = CO(g) ΔH=-110.5 kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:______________________________________。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是________。(填字母)
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) ΔH>0。汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是___________________。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g) = 2C(s)+O2(g)。已知该反应的ΔH>0,简述该设想能否实现的依据:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制变量是科学研究的重要方法。相同质量的锌粉与足量稀硫酸分别在下列条件下发生反应,开始阶段化学反应速率最大的是( )
选项 | A | B | C | D |
c(H2SO4)/(mol·L-1) | 0.5 | 2 | 0.5 | 2 |
t/℃ | 20 | 20 | 50 | 50 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置或操作设计正确、且能达到目的的是( )
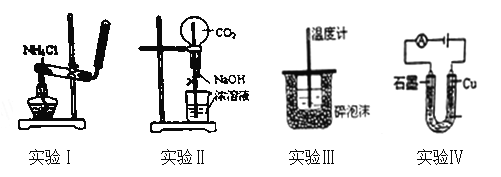
A. 实验Ⅰ:实验室制备氨气 B. 实验Ⅱ:用二氧化碳作喷泉实验
C. 实验Ⅲ:进行中和热的测定 D. 实验Ⅳ:电解氯化铜溶液得到铜和氯气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com