
| A、单位时间内生成1 mol CO2的同时消耗2 mol NH3 |
| B、形成6个N-H键的同时有2个C=O键断裂 |
| C、容器中CO2与NH3的物质的量之比保持不变 |
| D、混合气体的密度不再改变的状态 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
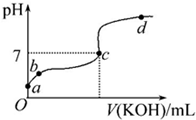 已知某温度下CH3COOH的电离常数K=1.6×10-5.该温度下向20mL 0.01mol?L-1CH3COOH溶液中逐滴加入0.01mol?L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化).请回答下列有关问题:
已知某温度下CH3COOH的电离常数K=1.6×10-5.该温度下向20mL 0.01mol?L-1CH3COOH溶液中逐滴加入0.01mol?L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化).请回答下列有关问题:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2υ正(N2)=υ逆(NH3) |
| B、3υ正(N2)=υ正(H2) |
| C、υ正(H2)=3υ逆(NH3) |
| D、υ正(N2)=3υ逆(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 在某钠盐溶液中滴加稀硫酸 | 产生能使石灰水变浑浊的气体 | 该溶液一定含有CO32-或HCO3- |
| B | KIO3溶液中加入HI溶液,并加入淀粉 | 溶液变蓝色 | KIO3的氧化性比I2强 |
| C | 在Na2S溶液中滴加盐酸 | 产生臭鸡蛋气味的气体 | 氯的非金属性比硫的非金属性强 |
| D | CO还原Fe2O3得到的黑色固体加入盐酸溶解后再加入KSCN溶液 | 溶液不显红色 | 黑色固体中无Fe3O4 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇与2mol?L-1的硫酸溶液混合加热到170℃制乙烯 |
| B、苯与溴水反应制取溴苯 |
| C、要鉴别己烯中是否混有少量甲苯,最恰当的实验方法是先加足量的酸性高锰酸钾溶液,然后再加入溴水 |
| D、电石与饱和食盐水作用制乙炔 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com