
【题目】有一包白色粉末X,由BaCl2、K2SO4、CaCO3、NaOH、CuCl2、KCl中的一种或几种组成,为了探究其成分,进行了如下实验:
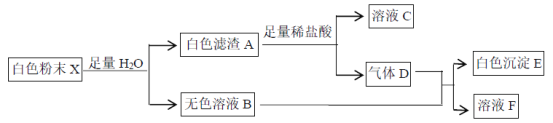
下列判断正确的是
A. 白色滤渣A可能为CaCO3、BaSO4的混合物
B. K2SO4、CuCl2一定不存在
C. KCl、K2SO4可能存在
D. CaCO3、BaCl2一定存在,NaOH可能存在
【答案】B
【解析】
由流程可知,白色固体溶于水,得到无色溶液,则一定不含CuCl2,白色滤渣A与足量稀盐酸反应生成气体D和溶液C,则滤渣A为CaCO3,不含BaSO4,生成的气体D为CO2;CO2与无色溶液B反应生成白色沉淀E和溶液F,则白色沉淀E为BaCO3,则一定含有BaCl2、NaOH,一定没有K2SO4;可能存在KCl;据此分析解答。
A.白色滤渣A只有CaCO3,不存在BaSO4,因为加入足量稀盐酸后没有沉淀剩余,故A错误;
B.结合分析可知,原混合物中一定不存在K2SO4、CuCl2,故B正确;
C.根据上述分析,可能含有KCl,一定不存在K2SO4,故C错误;
D.如果没有NaOH,BaCl2与二氧化碳不反应,无法生成碳酸钡沉淀,则一定含有NaOH,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是
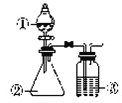
选项 | ① | ② | ③ | 实验结论 |
A | 酸性高锰酸钾 | 浓盐酸 | NaHCO3溶液 | Cl2与水反应生成酸性物质 |
B | 浓硫酸 | 蔗糖 | 澄清石灰水 | 浓硫酸具有脱水性、氧化性 |
C | 浓硝酸 | 铁片 | NaOH溶液 | 铁和浓硝酸反应可生成NO |
D | 稀盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把6 mol A气体和5 mol B气体混合充入4 L 密闭容器中,在一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),经5 s达到平衡,此时生成C为2 mol ,测得D的平均反应速率为0.1 mol·L-1·s-1,下列说法错误的是( )
2C(g)+xD(g),经5 s达到平衡,此时生成C为2 mol ,测得D的平均反应速率为0.1 mol·L-1·s-1,下列说法错误的是( )
A. x=2B. B的转化率为20%
C. 平衡时A的浓度为0.75 mol·L-1D. 恒温达到平衡时容器内的压强为开始的75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
![]()
A.摩尔是国际单位制中7个基本物理量之一
B.阿伏加德罗常数等于6.02×1023个12C中含有的碳原子数
C.物质的量是能把物质的质量和微观粒子数联系起来的一个物理量
D.若一分子NO、N2O的质量分别为ag、bg,则N原子的摩尔质量是(b-a)g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 由中科院等离子体物理研究所自主研制的全超导托卡马克实验装置(俗称“人造太阳”)正在接受技术升级。人造太阳是利用氘、氚核聚变反应释放巨大能量原理而实现的。下列说法正确的是________。
A.氕、氘、氚三种元素在周期表中的位置不同
B.20 g D2O含有的中子数为6.02×1024个
C.在隔绝空气和高温下LiCl与金属钠反应可获得金属锂
Ⅱ. 部分元素在周期表中的位置如下:
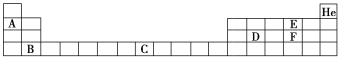
请回答下列问题:
(1)元素C在周期表中的位置为________。
(2)判断E和F对应的简单氢化物沸点高低,并解释原因____________。
(3)用电子式表示F的氢化物的形成过程:___________。
Ⅲ.溴及其化合物广泛用于医药、塑料阻燃剂等,苦卤提溴的工业流程如下:
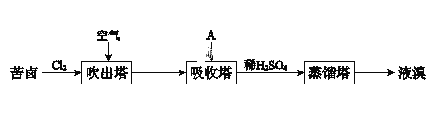
(1)结合元素周期律解释Cl的非金属性强于Br的原因:_______________。
(2)吸收塔中,A吸收了Br2后的溶液中含有Br和BrO3,则A是________(填序号)。
A.NaCl溶液 B.Na2CO3溶液 C.SO2气体
(3)从吸收塔出来的溶液中加入稀H2SO4得到Br2的离子方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学用如图所示装置进行铜与浓硫酸的反应,并探究产物的性质 (夹持装置已略去)。

(1)试管①中反应的化学方程式是______;
(2)若试管②中的试剂为品红溶液,实验中观察到的现象是______;
若试管②中的试剂为酸性KMnO4溶液,实验时,观察到溶液褪色,则说明生成的气体具有______性。
(3)试管③中的试剂为NaOH溶液,其作用是______,反应的离子方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D均为中学化学常见的纯净物,A是单质,它们有如图反应关系。下列说法错误的是( )

A.若A是大气中含量最多的气体,C、D是氧化物且会造成光化学污染。则D转化成C的反应化学方程为3NO2+H2O=2HNO3+2NO
B.若A、B、C分别为C(s)、CO(g)和CO2(g),且通过与O2(g)反应实现图示的转化。在同温同压且消耗含碳物质均为1mol时,反应①、②、③的焓变依次为△H 1、△H 2、△H 3,则它们之间的关系为 △H 2=△H 1+△H 3
C.若C为一元强碱且阴、阳离子所含的电子数相同,D为日常生活中常用的调味品,工业上用D制备A的化学方程式2Na2O(熔融)![]() 4Na+O2↑
4Na+O2↑
D.若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种气态非金属单质实验室保存D溶液的方法是加入适量铁粉与适量盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2(g)![]() 2NO(g)+O2(g)在密闭容器中反应,达到平衡状态的标志是( )
2NO(g)+O2(g)在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时,生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A. ①④⑥B. ②③⑤C. ①③④D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的密闭容器中发生反应2SO2 + O2 ![]() 2SO3,下列说法正确的是
2SO3,下列说法正确的是
A. 2 molSO2和1 molO2反应可生成2 molSO3
B. 向上述反应中再加入18O2,达平衡时,18O只存在于SO3中
C. 升高温度,只能加快2SO2+O2![]() 2SO3(g)反应的正反应速率
2SO3(g)反应的正反应速率
D. 选择适宜的催化剂能增大反应速率,提高生产效率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com