
【题目】化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是______(填字母)。
A.Na2O与水反应 B.甲烷的燃烧反应 C.CaCO3受热分解 D.锌与盐酸反应
(2)获取能量变化的途径
① 通过化学键的键能计算。已知:
化学键种类 | H—H | O=O | O—H |
键能(kJ/mol) | 436 | 498 | 463.4 |
计算可得:2H2(g)+ O2(g) =2H2O(g) H=____________kJ·mol-1
② 通过物质所含能量计算。已知反应中A+B=C+D中A、B、C、D所含能量依次可表示为E A、EB、 EC、 ED,该反应△H=_______。
③ 通过盖斯定律可计算。已知在25℃、101kPa时:
Ⅰ.2Na(s)+![]() O2 (g) =Na2O(s) △H=-414kJ·mol-1
O2 (g) =Na2O(s) △H=-414kJ·mol-1
Ⅱ.2Na(s)+O2(g) =Na2O2(s) △H=-511kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式__________。
④利用实验装置测量。测量盐酸与NaOH溶液反应的热量变化的过程中,若取50 mL 0.50 mol·L-1的盐酸,则还需加入________(填序号)。
A.50 mL 0.50 mol·L-1 NaOH溶液
B.50 mL 0.55 mol·L-1NaOH溶液
C.1.0 g NaOH固体
【答案】C -483.6 EC+ ED—(EA+EB) Na2O2(s)+2Na(s)====2Na2O(s)△H=-317 kJ·mol-1 B
【解析】
考查反应热的计算。根据△H=断键键能总和-成键键能总和或者△H=生成物总能量-反应物总能量进行解答;
(1)A.Na2O与水反应 属于放热反应,故A不符合;
B.甲烷的燃烧反应属于放热反应,故B不符合;
C.CaCO3受热分解属于吸热反应,故C符合;
D.锌与盐酸反应属于放热反应,故D不符合;
所以,属于吸热反应的是C;
(2)①根据2H2(g)+ O2(g) =2H2O(g)方程式可知,△H=断键键能总和-成键键能总和,即H=2H—H+ O=O- 4O—H =2×436+498-463.4×4=-483.6 kJ·mol-1;
② 通过物质所含能量计算△H=生成物总能量-反应物总能量。所以反应A+B=C+D中△H= EC+ED-(EA+EB);
③ 通过盖斯定律可I×2-II:2Na(s)+ Na2O2(s)= 2Na2O(s) △H =-414kJ·mol-1×2-(-511kJ·mol-1)=-317 kJ·mol-1;所以Na2O2与Na反应生成Na2O的热化学方程式为:Na2O2(s)+2Na(s) ==2Na2O(s) △H=-317 kJ·mol-1;
④测量盐酸与NaOH溶液反应的热量变化的过程中,为了保证酸或是碱中的一方完全反应,往往保证一方过量,所以若取50 mL 0.50 mol·L-1的盐酸,还需加入50 mL 0.55 mol·L-1NaOH溶液;因此,本题正确答案是:B。


科目:高中化学 来源: 题型:
【题目】有效控制大气温室气体浓度,推动绿色低碳发展,是人类可持续发展的重要战略之一,因此捕集、利用CO2始终是科学研究的热点。
(1)新的研究表明,可以将CO2转化为炭黑回收利用,反应原理如图所示。
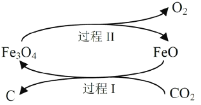
①碳在元素周期表中的位置是_______________。
②整个过程中FeO的作用是__________________。
③写出CO2转化为炭黑的总反应化学方程式__________________。
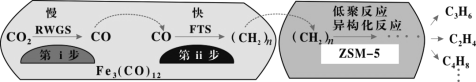
(2)我国科学家用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
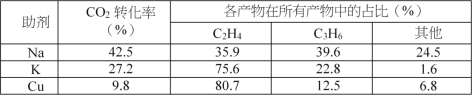
①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加____________助剂效果最好;
②加入助剂能提高单位时间内乙烯产量的根本原因是____________。
(3)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理如右图所示。
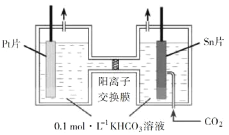
①写出阴极CO2还原为HCOO的电极反应式:________________________。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家正在研究温室气体CH4和CO2的转化和利用。
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为______。
(2)下列关于CH4和CO2的说法正确的是______(填序号)。
a.固态CO2属于分子晶体
b. CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2。
①基态Ni原子的电子排布式为____________,Ni该元素位于元素周期表的第___族。
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有_____molσ键。
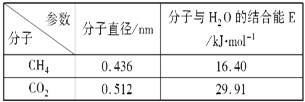
(4)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表.CH4与H2O形成的水合物俗称“可燃冰”。
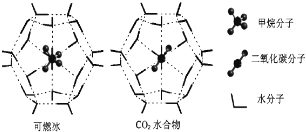
①“可燃冰”中分子间存在的2种作用力是______。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想.已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
B.![]() =1×10-12的溶液中:K+、
=1×10-12的溶液中:K+、![]() 、
、![]() 、
、![]()
C.![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
D.能使甲基橙变红的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化反应之一:NO(g)+CO(g)![]()
![]() N2 (g)+CO 2 (g) ΔH=-373.4 kJ·mol-1。若反应在恒容的密闭容器中达到平衡状态,下列说法正确的是
N2 (g)+CO 2 (g) ΔH=-373.4 kJ·mol-1。若反应在恒容的密闭容器中达到平衡状态,下列说法正确的是
A. 及时除去二氧化碳,正反应速率加快
B. 混合气体的密度不变是该平衡状态的标志之一
C. 降低温度,反应物的转化率和平衡常数均增大
D. 其它条件不变,加入催化剂可提高反应物的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是大气中的有害物质,需要对其进行综合治理和利用。
(1)工业上常用氨水吸收法处理SO2,可生成(NH4)2SO3或NH4HSO3。
① (NH4)2SO3显碱性,用化学平衡原理解释其原因:____________。
② NH4HSO3显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确的是____(填字母)。
a.c(NH4+)=2c(SO32-)+c(HSO3-)
b.c(NH4+)>c(SO32-)> c(H+)=c(OH-)
c.c(NH4+)+c(H+)=c(SO32-) +c(HSO3-)+c(OH-)
(2)某工厂烟气中主要含SO2、CO2,在较高温度经下图所示方法脱除SO2,可制得H2SO4。
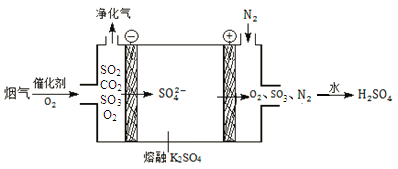
①在阴极放电的物质是_______。
②在阳极生成SO3的电极反应式是______。
(2)检测烟气中SO2脱除率的步骤如下:
a.将一定量的净化气(不含SO3)通入足量NaOH溶液后,再加入足量溴水。
b.加入浓盐酸,加热溶液至无色无气泡,再加入足量BaCl2溶液。
c.过滤、洗涤、干燥,称量沉淀质量。
①用离子方程式表示a中溴水的主要作用________________。
②若沉淀的质量越大,说明SO2的脱除率越_____(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X(C4H6O5)广泛存在于许多水果内,尤以苹果、葡萄、西瓜、山楂内为多,该化合物具有如下性质:
(1)1molX与足量的金属钠反应产生1.5 mol气体
(2)X与醇或羧酸在浓H2SO4和加热的条件下均生成有香味的产物
(3)X在一定程度下的分子内脱水产物(不是环状化合物)可和溴水发生加成反应
根据上述信息,对X的结构判断正确的是 ( )
A.X中肯定有碳碳双键
B.X中可能有三个羟基和一个-COOR官能团
C.X中可能有三个羧基
D.X中可能有两个羧基和一个羟基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。回答下列问题:
(1)在周期表中,与Li的化学性质最相似的邻族元素是________,该元素基态原子核外M层电子的自旋状态_________(填“相同”或“相反”)。
(2)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为________,其中Fe的配位数为_____________。
(3)苯胺![]() )的晶体类型是__________。苯胺与甲苯(
)的晶体类型是__________。苯胺与甲苯(![]() )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是___________。
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是___________。
(4)NH4H2PO4中,电负性最高的元素是______;P的_______杂化轨道与O的2p轨道形成_______键。
(5)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:

这类磷酸根离子的化学式可用通式表示为____________(用n代表P原子数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com