
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
B.![]() =1×10-12的溶液中:K+、
=1×10-12的溶液中:K+、![]() 、
、![]() 、
、![]()
C.![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
D.能使甲基橙变红的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
科目:高中化学 来源: 题型:
【题目】咖啡酰奎宁酸具有抗菌、抗病霉作用,其一种合成路线如图:
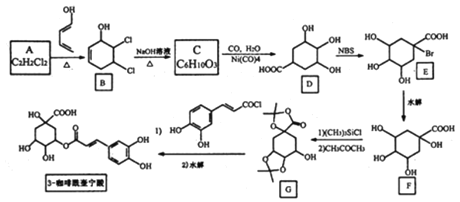
回答下列问题:
(1)A的化学名称是:___________,B中官能团的名称为___________;
(2)A到B、D到E的反应类型依次是____________;
(3)G的分子式为________________;
(4)B生成C的化学方程式为__________;
(5)X是C的同分异构体,其能发生银镜反应和水解反应,核磁共振氢谱有2组峰,且峰面积比为9:1,写出符合题意的X的一种结构简式:____________;
(6)设计以1,3-丁二烯和氯乙烯为起始原料制备 的合成路线:_________(无机试剂任用)。
的合成路线:_________(无机试剂任用)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年为“国际化学元素周期表年”。如图所示是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法不正确的是
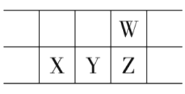
A.原子半径:W<X
B.气态氢化物热稳定性:Z<W
C.Y单质可用做半导体材料
D.X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空。
(1) 原子序数为24的元素基态原子核外有________个未成对电子,电子占据的最高能层符号为______,该能层具有的原子轨道数为________;
(2)B元素基态原子中能量最高的电子其电子云在空间有___个伸展方向,原子核外有___个运动状态不同的电子。
(3)在下列物质中:①NH3 ②I2 ③CH4 ④Na2O2 ⑤H2O2 ⑥CO2 ⑦NaOH ⑧CH3COONH4,既存在非极性键又存在极性键的极性分子是__________;既存在σ键又存在π键的非极性分子是________,既存在σ键又存在π键的离子晶体是________
(4)1mol NH4BF4含有___mol配位键, 1mol [Zn(CN)4]2-中含有σ键的数目为___.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究化学反应A+B![]() C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
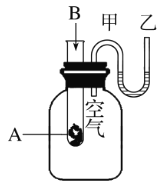
(1)该反应为________(填“放热”或“吸热”)反应。
(2)A和B的总能量比C和D的总能量_______(填“高”或“低”)。
(3)物质中的______能转化成______能释放出来。
(4)反应物化学键断裂吸收的能量__________(填“高”或“低”)于生成物化学键形成放出的能量。
(5)写出一个符合题中条件的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种生产高氯酸(HClO4)的工艺流程如图所示,该流程同时产出重要含氯消毒剂(ClO2)和漂白剂亚氯酸钠(NaClO2):
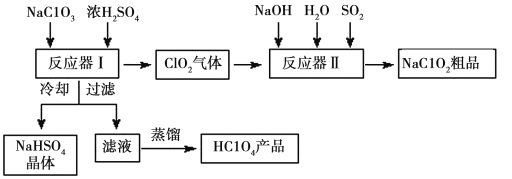
已知:①NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。
②高氯酸是一种强酸,沸点130℃左右。.
请回答下列问题:
(1)完成反应器1中生成高氯酸的化学方程式:NaClO3+H2SO4=HClO4+__ClO2↑+NaHSO4+![]() ___。冷却的目的是__,能用蒸馏法分离出高氯酸的原因是___。
___。冷却的目的是__,能用蒸馏法分离出高氯酸的原因是___。
(2)反应器II中发生反应的离子方程式为___。
(3)通入反应器II中的SO2用H2O2代替同样能生成NaClO2,请简要说明H2O2能代替SO2的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是______(填字母)。
A.Na2O与水反应 B.甲烷的燃烧反应 C.CaCO3受热分解 D.锌与盐酸反应
(2)获取能量变化的途径
① 通过化学键的键能计算。已知:
化学键种类 | H—H | O=O | O—H |
键能(kJ/mol) | 436 | 498 | 463.4 |
计算可得:2H2(g)+ O2(g) =2H2O(g) H=____________kJ·mol-1
② 通过物质所含能量计算。已知反应中A+B=C+D中A、B、C、D所含能量依次可表示为E A、EB、 EC、 ED,该反应△H=_______。
③ 通过盖斯定律可计算。已知在25℃、101kPa时:
Ⅰ.2Na(s)+![]() O2 (g) =Na2O(s) △H=-414kJ·mol-1
O2 (g) =Na2O(s) △H=-414kJ·mol-1
Ⅱ.2Na(s)+O2(g) =Na2O2(s) △H=-511kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式__________。
④利用实验装置测量。测量盐酸与NaOH溶液反应的热量变化的过程中,若取50 mL 0.50 mol·L-1的盐酸,则还需加入________(填序号)。
A.50 mL 0.50 mol·L-1 NaOH溶液
B.50 mL 0.55 mol·L-1NaOH溶液
C.1.0 g NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子交换法净化水过程如图所示。下列说法中错误的是

A. 经过阳离子交换树脂后,水中阳离子的总数不变
B. 水中的![]() 、
、![]() 、Cl通过阴离子树脂后被除去
、Cl通过阴离子树脂后被除去
C. 通过净化处理后,水的导电性降低
D. 阴离子树脂填充段存在反应H++OH![]() H2O
H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现欲用纯净的CaCO3与稀盐酸反应制取CO2,生成CO2的体积与时间的关系如图所示。下列叙述正确的是
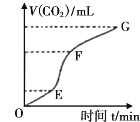
A.OE段化学反应速率最快
B.FG段收集的二氧化碳最多
C.由图像可推断出该反应为吸热反应
D.向溶液中加入氯化钠溶液,可以降低该反应的化学反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com