
【题目】完成下列填空。
(1) 原子序数为24的元素基态原子核外有________个未成对电子,电子占据的最高能层符号为______,该能层具有的原子轨道数为________;
(2)B元素基态原子中能量最高的电子其电子云在空间有___个伸展方向,原子核外有___个运动状态不同的电子。
(3)在下列物质中:①NH3 ②I2 ③CH4 ④Na2O2 ⑤H2O2 ⑥CO2 ⑦NaOH ⑧CH3COONH4,既存在非极性键又存在极性键的极性分子是__________;既存在σ键又存在π键的非极性分子是________,既存在σ键又存在π键的离子晶体是________
(4)1mol NH4BF4含有___mol配位键, 1mol [Zn(CN)4]2-中含有σ键的数目为___.
【答案】6 N 16 3 8 ⑤ ⑥ ⑧ 2 8NA
【解析】
本题主要考察原子的核外电子排布、电子轨道、分子极性、共价键和配位键的构成。
(1)24号元素为Cr,其核外电子排布为1s22s22p63s23p63d54s1,根据洪特规则可知有6个未成对电子,电子占据的最高能层为第4层,其符号为N,该能层具有的原子轨道有1个s轨道、3个p轨道、5个d轨道、7个f轨道,共16个;
(2)B原子的核外电子排布为1s22s22p1,其能量最高的电子是2p电子,该电子的电子云在空间有3个伸展方向;由于每个电子的运动状态都不同,所以B原子核外有5个运动状态不同的电子;
(3)①NH3是极性分子,只含有N-H单键,是极性键,该分子含有σ键;
②I2是非极性分子,只含有I-I单键,是非极性键,该分子含有σ键;
③CH4是非极性分子,只含有C-H单键,是极性键,该分子含有σ键;
④Na2O2是离子化合物,不属于分子,其含有的O-O单键,是非极性键,该物质含有σ键;
⑤H2O2是是极性分子,含有O-H单键和O-O单键,即该分子含有极性键和非极性键,该分子含有σ键;
⑥CO2是非极性分子,只含有C=O双键,是极性键,该分子含有σ键和π键;
⑦NaOH是离子化合物,不属于分子,其含有的O-H单键,是极性键,该物质含有σ键;
⑧CH3COONH4是离子化合物,不属于分子,其含有的C-C单键是非极性键,C-H单键、N-H单键、C-O单键、C=O双键都是极性键,该物质含有σ键和π键;
故既存在非极性键又存在极性键的极性分子是⑤;既存在σ键又存在π键的非极性分子是⑥;既存在σ键又存在π键的离子晶体是⑧;
(4)在1个NH4+、BF4-中,都含有1个配位键,所以1mol NH4BF4含有2mol配位键;1个[Zn(CN)4]2-中,含有4个![]() 键和4个配位键,则1mol该离子含有8mol σ键。
键和4个配位键,则1mol该离子含有8mol σ键。


科目:高中化学 来源: 题型:
【题目】下列说法中可以说明2HI(g)![]() H2(g)+I2(g)已达到平衡状态的是( )
H2(g)+I2(g)已达到平衡状态的是( )
(1)单位时间内生成n mol H2的同时生成n mol HI
(2)一个H—H键断裂的同时有两个H—I键断裂
(3)c(HI)= c(I2)
(4)反应速率υ(H2)=υ(I2)=0.5υ(HI)
(5)c(H2)∶c(I2)∶c(HI)=2∶1∶1
(6)温度和体积一定时,某一生成物浓度不再变化
(7)温度和体积一定时,容器内压强不再变化
(8)条件一定,混合气体的平均相对分子质量不再变化
(9)温度和体积一定时,混合气体的颜色不再发生变化
(10)温度和压强一定时,混合气体的密度不再发生变化
A. (1)(2)(5)(9)(10) B. (2)(6)(9) C. (6)(7)(10) D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关晶体的叙述中,不正确的是
A. 氯化铯晶体中,每个Cs+周围紧邻8个Cl-
B. SiO2晶体为空间网状结构,由共价键形成的原子环中,最小的环上有12个原子
C. 干冰晶体中,每个CO2分子周围紧邻12个CO2分子
D. 金属铜属于六方最密堆积结构,金属镁属于面心立方最密堆积结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家正在研究温室气体CH4和CO2的转化和利用。
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为______。
(2)下列关于CH4和CO2的说法正确的是______(填序号)。
a.固态CO2属于分子晶体
b. CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2。
①基态Ni原子的电子排布式为____________,Ni该元素位于元素周期表的第___族。
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有_____molσ键。
(4)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表.CH4与H2O形成的水合物俗称“可燃冰”。
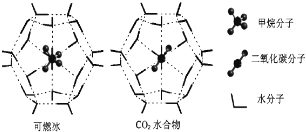
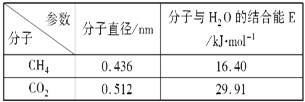
①“可燃冰”中分子间存在的2种作用力是______。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想.已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
B.![]() =1×10-12的溶液中:K+、
=1×10-12的溶液中:K+、![]() 、
、![]() 、
、![]()
C.![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
D.能使甲基橙变红的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是大气中的有害物质,需要对其进行综合治理和利用。
(1)工业上常用氨水吸收法处理SO2,可生成(NH4)2SO3或NH4HSO3。
① (NH4)2SO3显碱性,用化学平衡原理解释其原因:____________。
② NH4HSO3显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确的是____(填字母)。
a.c(NH4+)=2c(SO32-)+c(HSO3-)
b.c(NH4+)>c(SO32-)> c(H+)=c(OH-)
c.c(NH4+)+c(H+)=c(SO32-) +c(HSO3-)+c(OH-)
(2)某工厂烟气中主要含SO2、CO2,在较高温度经下图所示方法脱除SO2,可制得H2SO4。
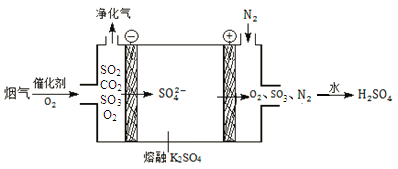
①在阴极放电的物质是_______。
②在阳极生成SO3的电极反应式是______。
(2)检测烟气中SO2脱除率的步骤如下:
a.将一定量的净化气(不含SO3)通入足量NaOH溶液后,再加入足量溴水。
b.加入浓盐酸,加热溶液至无色无气泡,再加入足量BaCl2溶液。
c.过滤、洗涤、干燥,称量沉淀质量。
①用离子方程式表示a中溴水的主要作用________________。
②若沉淀的质量越大,说明SO2的脱除率越_____(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是一种常用的内服止痛解热药。1 mol A 水解得到1 mol B 和1 mol 醋酸。A溶液具有酸性,不能使FeCl3溶液显色。A的相对分子质量不超过200。B分子中碳元素和氢元素总的质量分数为0.652。A、B都是由碳、氢、氧三种元素组成的芳香族化合物。则下列推断中,正确的是( )
A. A、B的相对分子质量之差为60B. 1个B分子中应当有2个氧原子
C. A的分子式是C7H6O3D. B能与NaOH溶液、FeCl3溶液、浓溴水等物质反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com