
【题目】一种生产高氯酸(HClO4)的工艺流程如图所示,该流程同时产出重要含氯消毒剂(ClO2)和漂白剂亚氯酸钠(NaClO2):
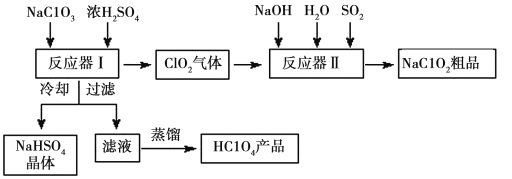
已知:①NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。
②高氯酸是一种强酸,沸点130℃左右。.
请回答下列问题:
(1)完成反应器1中生成高氯酸的化学方程式:NaClO3+H2SO4=HClO4+__ClO2↑+NaHSO4+![]() ___。冷却的目的是__,能用蒸馏法分离出高氯酸的原因是___。
___。冷却的目的是__,能用蒸馏法分离出高氯酸的原因是___。
(2)反应器II中发生反应的离子方程式为___。
(3)通入反应器II中的SO2用H2O2代替同样能生成NaClO2,请简要说明H2O2能代替SO2的原因是___。
【答案】3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O 降低NaHSO4的溶解度,使NaHSO4结晶析出 HClO4沸点低,且与滤液中其他成分沸点差异较明显 2ClO2+SO2+4OH-=2![]() +
+![]() +2H2O H2O2有还原性,也能把ClO2还原为NaClO2
+2H2O H2O2有还原性,也能把ClO2还原为NaClO2
【解析】
(1) 根据得失电子守恒和原子守恒,书写出化学反应方程式;冷却的目的是是利用NaHSO4溶解度来冷却结晶;用蒸馏法分离混合物是因为两者的沸点相差明显;
(2) 根据通入到反应容器Ⅱ中的反应物有NaOH、SO2、H2O、ClO2,生成物有NaClO2,根据氧化还原反应的得失电子守恒,和质量守恒定律来配平离子方程式;
(3) SO2用H2O2代替同样能生成NaClO2,因为H2O2与SO2一样具有还原性。
(1)反应中Cl元素的化合价部分由+5价升至+7价、部分由+5价降至+4价,根据得失电子守恒和原子守恒,书写出化学反应方程式为:3NaClO3+3H2SO4=HClO4+2ClO2+3NaHSO4+H2O;因为硫酸氢钠的溶解度随温度的升高而增大,将反应生成物的溶液冷却得到NaHSO4晶体,过滤后,将滤液蒸馏得到纯净的HClO4,是因为高氯酸的沸点低,且与滤液中其他成分沸点差异较明显,故答案为:3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O;降低NaHSO4的溶解度,使NaHSO4结晶析出;HClO4沸点低,且与滤液中其他成分沸点差异较明显;
(2) 根据通入到反应容器Ⅱ中的反应物有NaOH、SO2、H2O、ClO2,生成物有NaClO2,氯的化合价由+4价变成了+3价,得到电子,根据氧化还原反应的原理硫应失电子,由+4价变成+6价,根据氧化还原反应原理:氧化剂得到电子总数等于还原剂失去电子的总数,则氧化还原反应方程式为:2ClO2+SO2+4OH-=2![]() +
+![]() +2H2O,故答案为:2ClO2+SO2+4OH-=2
+2H2O,故答案为:2ClO2+SO2+4OH-=2![]() +
+![]() +2H2O;
+2H2O;
(3) 如果将反应器Ⅱ中的SO2用H2O2代替同样能生成NaClO2,说明变换物质后,氧化还原反应照样能发生生成NaClO2,也就说明H2O2也具有还原性,也能把ClO2还原为NaClO2,故答案为:H2O2有还原性,也能把ClO2还原为NaClO2。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】二氧化硫通入氯化钡溶液中理论上不产生沉淀,而实际受到空气和溶液中氧气的影响很快便能观察到沉淀现象。为了避免产生沉淀,某化学小组设计了如下实验装置,实验操作步骤如下:

①气密性检査完好后,在装置A中的多孔隔板上放上锌粒,通过_______注入稀硫酸、打开活塞,将产生的氢气导入到后续装置。
②________后,关闭活塞,将装置D的导管插入烧杯中。
③通过装置B的________滴加浓硫酸,产生的气体进入到BaCl2溶液中,溶液保持澄清。
④打开活塞,将产生的氢气导入后续装置一段时间。
⑤将盛有BaCl2溶液的试管从装置中取出,拔去橡皮塞用胶头滴管伸入到苯层下方滴加双氧水,随即出现白色浑浊,滴加稀盐酸并振荡,白色浑浊不消失。
⑥拆卸装置,清洗仪器,处理剩余药品。
请回答下列问题:
(1)实验步骤①和③的空白处使用的仪器分别为__________、__________
(2)装置C中苯的作用是__________。
(3)实验步骤②的操作为__________。
(4)实验步骤④的目的是__________。
(5)写出实验步骤⑤试管中发生反应的化学方程式:__________、____________。
(6)为了避免产生沉淀,你认为还应采取哪些措施?请举一例:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关晶体的叙述中,不正确的是
A. 氯化铯晶体中,每个Cs+周围紧邻8个Cl-
B. SiO2晶体为空间网状结构,由共价键形成的原子环中,最小的环上有12个原子
C. 干冰晶体中,每个CO2分子周围紧邻12个CO2分子
D. 金属铜属于六方最密堆积结构,金属镁属于面心立方最密堆积结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
B.![]() =1×10-12的溶液中:K+、
=1×10-12的溶液中:K+、![]() 、
、![]() 、
、![]()
C.![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
D.能使甲基橙变红的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】400℃时,向一个容积为2L的密闭容器中充入一定量的CO和H2,发生如下反应:CO(g)+2H2(g)![]() CH3OH(g)。反应过程中测得的部分数据见下表:
CH3OH(g)。反应过程中测得的部分数据见下表:
t/min | 0 | 10 | 20 | 30 |
n(CO)/mol | 0.20 | 0.08 | 0.04 | |
n(H2)/mol | 0.40 | 0.08 |
下列说法不正确的是
A. 反应在前10min内的平均速率为v(H2)=0.012 mol/(L·min)
B. 400℃时,该反应的平衡常数数值为2.5×103
C. 保持其他条件不变,升高温度,平衡时c(CH3OH)=0.06mol·L-1,则反应的ΔH<0
D. 相同温度下,若起始时向容器中充入0.3mol CH3OH,达到平衡时CH3OH的转化率大于20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是大气中的有害物质,需要对其进行综合治理和利用。
(1)工业上常用氨水吸收法处理SO2,可生成(NH4)2SO3或NH4HSO3。
① (NH4)2SO3显碱性,用化学平衡原理解释其原因:____________。
② NH4HSO3显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确的是____(填字母)。
a.c(NH4+)=2c(SO32-)+c(HSO3-)
b.c(NH4+)>c(SO32-)> c(H+)=c(OH-)
c.c(NH4+)+c(H+)=c(SO32-) +c(HSO3-)+c(OH-)
(2)某工厂烟气中主要含SO2、CO2,在较高温度经下图所示方法脱除SO2,可制得H2SO4。
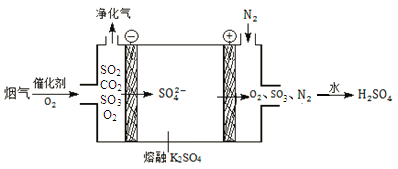
①在阴极放电的物质是_______。
②在阳极生成SO3的电极反应式是______。
(2)检测烟气中SO2脱除率的步骤如下:
a.将一定量的净化气(不含SO3)通入足量NaOH溶液后,再加入足量溴水。
b.加入浓盐酸,加热溶液至无色无气泡,再加入足量BaCl2溶液。
c.过滤、洗涤、干燥,称量沉淀质量。
①用离子方程式表示a中溴水的主要作用________________。
②若沉淀的质量越大,说明SO2的脱除率越_____(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备铝的主要原料。工业上制取铝的工艺流程如下:
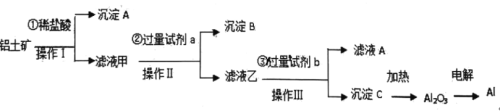
(1)沉淀A____________,沉淀C是___________。
(2)操作Ⅰ、Ⅱ、Ⅲ的名称是___________,所需要的玻璃仪器有___________
(3)滤液甲含有Fe3+,写出硫氰化钾溶液检验Fe3+的离子方程式___________。
(4)生成沉淀C的离子方程式___________
(5)若滤液甲中c(H+)=1.0mol·L-1,c(Al3+)=2.0mol·L-1,c(Fe3+)=2.0mol·L-1,现取100mL滤液,若要把Al3+、Fe3+分开,加入2mol/LNaOH溶液的体积至少为___________mL.
(6)已知铍和铝的性质类似,请写出铍和氢氧化钠溶液反应的离子方程式___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,1mol·L-1的CH3NH2和1mol·L-1的NH2OH(NH2OH+H2O![]() NH3OH++OHˉ)两种碱溶液,起始时的体积均为10mL,分别向两溶液中加水进行稀释,所得曲线如图所示(V表示溶液的体积),pOH=-lgc(OH-)。下列说法不正确的是
NH3OH++OHˉ)两种碱溶液,起始时的体积均为10mL,分别向两溶液中加水进行稀释,所得曲线如图所示(V表示溶液的体积),pOH=-lgc(OH-)。下列说法不正确的是
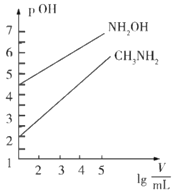
A. NH2OH的电离常数K的数量级为10-9
B. CH3NH3Cl盐溶液中水解离子方程式为:CH3NH2+H2O![]() CH3NH3++OH-
CH3NH3++OH-
C. 当两溶液均稀释至lg![]() =4时,溶液中水的电离程度:NH2OH >CH3NH2
=4时,溶液中水的电离程度:NH2OH >CH3NH2
D. 浓度相同的CH3NH3Cl和NH3OHCl的混合溶液中离子浓度大小关系:(NH3OH+)<c(CH3NH3+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com