
【题目】400℃时,向一个容积为2L的密闭容器中充入一定量的CO和H2,发生如下反应:CO(g)+2H2(g)![]() CH3OH(g)。反应过程中测得的部分数据见下表:
CH3OH(g)。反应过程中测得的部分数据见下表:
t/min | 0 | 10 | 20 | 30 |
n(CO)/mol | 0.20 | 0.08 | 0.04 | |
n(H2)/mol | 0.40 | 0.08 |
下列说法不正确的是
A. 反应在前10min内的平均速率为v(H2)=0.012 mol/(L·min)
B. 400℃时,该反应的平衡常数数值为2.5×103
C. 保持其他条件不变,升高温度,平衡时c(CH3OH)=0.06mol·L-1,则反应的ΔH<0
D. 相同温度下,若起始时向容器中充入0.3mol CH3OH,达到平衡时CH3OH的转化率大于20%
【答案】D
【解析】
A.容积为2L的密闭容器中充入0.20mol CO和0.40mol H2,发生:CO(g)+2H2(g)![]() CH3OH(g)反应,10min后n(CO)= 0.08mol,变化了0.12mol,H2变化了0.24mol,所以10min内的H2的平均速率为v(H2)=
CH3OH(g)反应,10min后n(CO)= 0.08mol,变化了0.12mol,H2变化了0.24mol,所以10min内的H2的平均速率为v(H2)=![]() =0.012 mol/(L·min);故A正确;
=0.012 mol/(L·min);故A正确;
B. 由表中的数据分析可知:20min时CO(g)+2H2(g)![]() CH3OH(g)反应达到平衡,各物质浓度变化情况为:
CH3OH(g)反应达到平衡,各物质浓度变化情况为:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
初始浓度(mol·L-1) 0.1 0.2 0
变化浓度(mol·L-1) 0.08 0.16 0.08
平衡浓度(mol·L-1) 0.02 0.04 0.08
400℃时,该反应的平衡常数K=![]() =2.5×103,故B正确;
=2.5×103,故B正确;
C. 保持其他条件不变,升高温度使反应达到平衡时c(CH3OH)=0.06mol·L-1<0.08 mol·L-1,说明平衡逆向移动了,Δ则该反应的ΔH<0,故C正确;
D. 当容积为2L的密闭容器中充入0.20mol CO和0.40mol H2,发生:CO(g)+2H2(g)![]() CH3OH(g)反应,达到平衡时,CO的转化率为80%;根据等效平衡,若开始加0.2mol的CH3OH时,达到平衡时CH3OH的转化率为20%;相同温度下,若起始时向容器中充入0.3mol CH3OH,相当于增减了反应物,达到平衡时CH3OH的转化率小于20%,故D错误;
CH3OH(g)反应,达到平衡时,CO的转化率为80%;根据等效平衡,若开始加0.2mol的CH3OH时,达到平衡时CH3OH的转化率为20%;相同温度下,若起始时向容器中充入0.3mol CH3OH,相当于增减了反应物,达到平衡时CH3OH的转化率小于20%,故D错误;
综上所述,本题正确答案:D。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】(1)0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态的三氧化二硼和液态水,放出649.5 kJ热量,其热化学方程式为____。
(2)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式为2NO+2CO![]() 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 |
c(NO)/ mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 |
c(CO)/mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 |
时间/s | 3 | 4 | 5 |
c(NO)/ mol·L-1 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO)/ mol·L-1 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题:
①前2s内的平均反应速率υ(N2)=____;
②上述条件下,该反应的平衡常数为____;
③上述条件下,测得某时刻反应体系中各物质的物质的量浓度均为0.01 mol/L,则此时反应处于____状态。(填“平衡”或“向右进行”或“向左进行”)
(3)实验室常用0.10 mol/L KMnO4标准酸性溶液来测定H2C2O4样品的纯度(标准液滴待测液),其反应原理为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O。
①KMnO4标准液应装在____(填“酸式”或“碱式”)滴定管;
② 清水洗净滴定管后直接装入标准液,则测定结果会____;(填“偏大”或“偏小”或“不变”)
③ 滴定过程中发现一段时间后反应速率明显加快,除去温度的影响,你认为最有可能的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
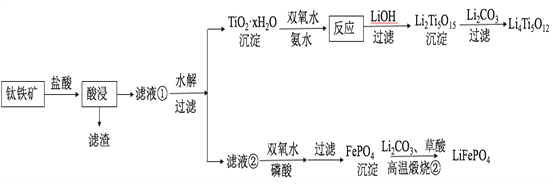
回答下列问题:
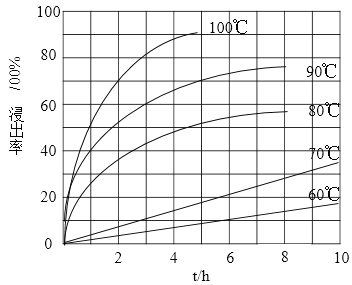
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有X、Y、Z、T四种短周期元素,原子序数依次增大。请根据下列相关信息,回答问题。
元素 | 相关信息 |
X | 原子的1s轨道上只有1个电子 |
Y | 原子的L层上s电子数等于p电子数 |
Z | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的 |
T | 负二价的元素T的氢化物在通常情况下是一种液体,且T的质量分数为88.9% |
(1) Z2X4分子中Z原子采取________杂化,写出与之互为等电子体的有机物的结构简式_____________________
(2) Cl2T分子的空间构型___________, Z2T的电子式_________________
(3) 请用价层电子对互斥理论解释ZX![]() 和ZX3的键角∠XZX的大小:_____________。
和ZX3的键角∠XZX的大小:_____________。
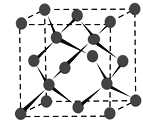
(4) Y晶体的晶胞如图所示,该晶胞含有______个Y原子,若晶胞的密度为d g·cm-3,阿伏加德罗常数的值为NA(mol-1),则晶胞参数为a=_______ pm。(用含d 、NA的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种生产高氯酸(HClO4)的工艺流程如图所示,该流程同时产出重要含氯消毒剂(ClO2)和漂白剂亚氯酸钠(NaClO2):
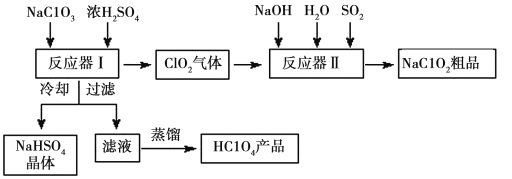
已知:①NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。
②高氯酸是一种强酸,沸点130℃左右。.
请回答下列问题:
(1)完成反应器1中生成高氯酸的化学方程式:NaClO3+H2SO4=HClO4+__ClO2↑+NaHSO4+![]() ___。冷却的目的是__,能用蒸馏法分离出高氯酸的原因是___。
___。冷却的目的是__,能用蒸馏法分离出高氯酸的原因是___。
(2)反应器II中发生反应的离子方程式为___。
(3)通入反应器II中的SO2用H2O2代替同样能生成NaClO2,请简要说明H2O2能代替SO2的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工原料,工业制取硫酸最重要的一步反应为:2SO2(g)+O2(g) ![]() 2SO3(g) △H< 0
2SO3(g) △H< 0
(1)为提高SO2的转化率,可通入过量O2,用平衡移动原理解释其原因:___________。
(2)某兴趣小组在实验室对该反应进行研究,部分实验数据和图像如下。
反应条件:催化剂、一定温度、容积10 L
实验 | 起始物质的量/mol | 平衡时SO3 物质的量/mol | ||
SO2 | O2 | SO3 | ||
ⅰ | 0.2 | 0.1 | 0 | 0.12 |
ⅱ | 0 | 0 | 0.2 | a |
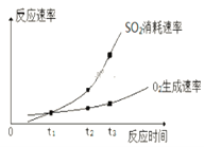
①实验ⅰ中SO2的转化率为______。
②a____0.12(填“>”、“=”或“<”)。
③t1、t2、t3中,达到化学平衡状态的是________。
④ t2到t3的变化是因为改变了一个反应条件,该条件可能是___________。
(3)将SO2和O2充入恒压密闭容器中,原料气中SO2 和O2的物质的量之比m(m=n(SO2)/n(O2))不同时,SO2的平衡转化率与温度(T)的关系如下图所示,则m1、m2、m3的大小顺序为_____。
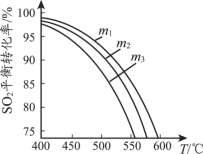
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2O3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________。该反应需要在加压下进行,原因是________。
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+![]() O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。
(4)298 K时,将20 mL 3x mol·L1 Na3AsO3、20 mL 3x mol·L1 I2和20 mL NaOH溶液混合,发生反应:AsO33(aq)+I2(aq)+2OH![]() AsO43(aq)+2I(aq)+ H2O(l)。溶液中c(AsO43)与反应时间(t)的关系如图所示。
AsO43(aq)+2I(aq)+ H2O(l)。溶液中c(AsO43)与反应时间(t)的关系如图所示。

①下列可判断反应达到平衡的是__________(填标号)。
a.溶液的pH不再变化
b.v(I)=2v(AsO33)
c. c (AsO43)/c (AsO33)不再变化
d. c(I)=y mol·L1
②tm时,v正_____ v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____ tn时v逆(填“大于”“小于”或“等于”),理由是_____________。
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z、W在周期表中的位置如图所示,其中Z元素的最外层电子数是内层电子总数的![]() 。下列说法不正确的是
。下列说法不正确的是
X | Y | |
Z | W |
A.Z元素位于周期表的第3周期第VA族
B.X、W元素的最高价氧化物对应水化物的酸性:W强于X
C.Y元素的气态氢化物的热稳定性比Z的高
D.X和Y都只能形成一种氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计实验探究CuSO4分解产物
Ⅰ.甲同学选择下列装置设计实验探究硫酸铜分解的气态产物SO3、SO2和O2,并验证SO2的还原性。
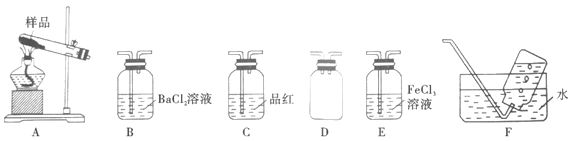
回答下列有关问题
(1)CuSO4水溶液呈酸性,其原因是______________________(用离子方程式表示)。
(2)上述装置按气流从左至右排序为A、D、___________E、F(填代号)。
(3)装置D的作用是___________;能证明有SO3生成的实验现象是___________。
(4)在实验过程中C装置中红色溶液逐渐变为无色溶液,说明A中分解产物有___________;待C中有明显现象后,F开始收集气体,F装置中集气瓶收集到了少量气体,该气体是___________(填化学式)。
(5)为了验证SO2的还原性,取E装置中反应后的溶液于试管中,设计如下实验:
a 滴加少量的NH4SCN溶液 b 滴加少量的K3[Fe(CN)6]溶液
c 滴加酸性KMnO4溶液 d 滴加盐酸酸化的BaCl2溶液
其中,方案合理的有___________(填代号),写出E装置中可能发生反应的离子方程式:_________。
Ⅱ.乙同学利用A中残留固体验证固体产物(假设硫酸铜已完全分解)
查阅资料知,铜有+2、+1价。Cu2O在酸性条件下不稳定,发生反应:Cu2O+2H+=Cu+Cu2++H2O。
(6)为了验证固体产物中是否有Cu2O,设计了下列4种方案,其中能达到实验目的的是___________。
甲:取少量残留固体于试管,滴加足量的稀硝酸,观察溶液颜色是否变为蓝色
乙:取少量残留固体于试管,滴加足量的稀硫酸,观察溶液颜色是否变为蓝色
丙:取少量残留固体于试管,滴加足量的稀盐酸,观察是否有红色固体生成
丁:取少量残留固体于试管,通入氢气,加热,观察是否生成红色固体
(7)经检验CuSO4分解生成CuO、Cu2O、SO3、SO2和O2,且CuO、Cu2O的质量之比为5:9,SO2、O2、SO3的体积之比(同温同压下测定)为4:3:2。写出CuSO4分解的化学方程式:_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com