
【题目】四种短周期元素X、Y、Z、W在周期表中的位置如图所示,其中Z元素的最外层电子数是内层电子总数的![]() 。下列说法不正确的是
。下列说法不正确的是
X | Y | |
Z | W |
A.Z元素位于周期表的第3周期第VA族
B.X、W元素的最高价氧化物对应水化物的酸性:W强于X
C.Y元素的气态氢化物的热稳定性比Z的高
D.X和Y都只能形成一种氧化物
科目:高中化学 来源: 题型:
【题目】下列关于杂化轨道的叙述中不正确的是
A. 分子中心原子通过sp3杂化轨道成键时该分子不一定为正四面体结构,所以杂化轨道理论与VSEPR模型分析分子的空间构型结果常常相互矛盾
B. 杂化轨道用于形成σ键或用于容纳未参与成键的孤电子对
C. SF2和C2H6分子中的中心原子S和C都是通过sp3杂化轨道成键
D. 苯分子中所有碳原子均采取sp2杂化成键,苯环中存在6个碳原子共有的大π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】400℃时,向一个容积为2L的密闭容器中充入一定量的CO和H2,发生如下反应:CO(g)+2H2(g)![]() CH3OH(g)。反应过程中测得的部分数据见下表:
CH3OH(g)。反应过程中测得的部分数据见下表:
t/min | 0 | 10 | 20 | 30 |
n(CO)/mol | 0.20 | 0.08 | 0.04 | |
n(H2)/mol | 0.40 | 0.08 |
下列说法不正确的是
A. 反应在前10min内的平均速率为v(H2)=0.012 mol/(L·min)
B. 400℃时,该反应的平衡常数数值为2.5×103
C. 保持其他条件不变,升高温度,平衡时c(CH3OH)=0.06mol·L-1,则反应的ΔH<0
D. 相同温度下,若起始时向容器中充入0.3mol CH3OH,达到平衡时CH3OH的转化率大于20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是
A. 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B. 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C. 由氯代环己烷消去制环己烯;由丙烯加溴制![]() 二溴丙烷
二溴丙烷
D. 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备铝的主要原料。工业上制取铝的工艺流程如下:
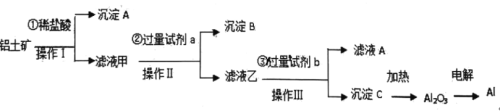
(1)沉淀A____________,沉淀C是___________。
(2)操作Ⅰ、Ⅱ、Ⅲ的名称是___________,所需要的玻璃仪器有___________
(3)滤液甲含有Fe3+,写出硫氰化钾溶液检验Fe3+的离子方程式___________。
(4)生成沉淀C的离子方程式___________
(5)若滤液甲中c(H+)=1.0mol·L-1,c(Al3+)=2.0mol·L-1,c(Fe3+)=2.0mol·L-1,现取100mL滤液,若要把Al3+、Fe3+分开,加入2mol/LNaOH溶液的体积至少为___________mL.
(6)已知铍和铝的性质类似,请写出铍和氢氧化钠溶液反应的离子方程式___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y两根金属棒插入Z溶液中构成如图的装置,实验中电流表指针发生偏转,同时X棒变粗,Y棒变细,则X、Y、Z可能是( )
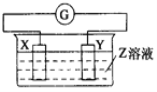
选项 | X | Y | Z |
A | Zn | Cu | 稀硫酸 |
B | Cu | Zn | 稀硫酸 |
C | Cu | Ag | 硫酸铜溶液 |
D | Ag | Zn | 硝酸银溶液 |
A.AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuO | |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于图像的描述错误的是( )
A.图I表示向盐酸中滴加NaAlO2溶液,沉淀质量随NaAlO2溶液体积的变化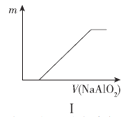
B.图II表示向NH4Al(SO4)2溶液中滴加NaOH溶液,沉淀质量随NaOH溶液体积的变化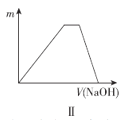
C.图III表示向NH4Cl溶液中加入稍过量Na2O2固体,产生气体的体积随Na2O2质量的变化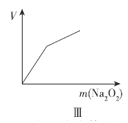
D.图IV表示向Na2CO3溶液中滴加稀盐酸,产生气体的体积随盐酸溶液体积的变化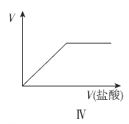
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。
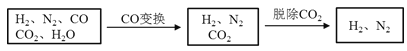
完成下列填空:
(1)半水煤气含有少量硫化氢。将半水煤气样品通入____溶液中(填写试剂名称),出现_______,可以证明有硫化氢存在。
(2)半水煤气在铜催化下实现CO变换:CO+H2O![]() CO2+H2
CO2+H2
若半水煤气中V(H2):V(CO):V(N2)=38:28:22,经CO变换后的气体中:V(H2):V(N2)=____________。
(3)碱液吸收法是脱除二氧化碳的方法之一。已知:
Na2CO3 | K2CO3 | |
20℃碱液最高浓度(mol/L) | 2.0 | 8.0 |
碱的价格(元/kg) | 1.25 | 9.80 |
若选择Na2CO3碱液作吸收液,其优点是__________;缺点是____________。如果选择K2CO3碱液作吸收液,用什么方法可以降低成本?
___________________________________________
写出这种方法涉及的化学反应方程式。_______________________
(4)以下是测定半水煤气中H2以及CO的体积分数的实验方案。
取一定体积(标准状况)的半水煤气,经过下列实验步骤测定其中H2以及CO的体积分数。
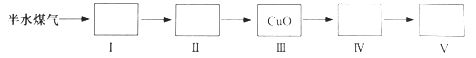
①选用合适的无机试剂分别填入Ⅰ、Ⅰ、Ⅳ、Ⅴ方框中。
②该实验方案中,步骤Ⅰ、Ⅱ的目的是:_________________。
③该实验方案中,步骤________(选填“Ⅳ”或“Ⅴ”)可以确定半水煤气中H2的体积分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com