
【题目】有效控制大气温室气体浓度,推动绿色低碳发展,是人类可持续发展的重要战略之一,因此捕集、利用CO2始终是科学研究的热点。
(1)新的研究表明,可以将CO2转化为炭黑回收利用,反应原理如图所示。
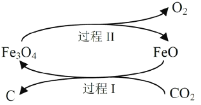
①碳在元素周期表中的位置是_______________。
②整个过程中FeO的作用是__________________。
③写出CO2转化为炭黑的总反应化学方程式__________________。
(2)我国科学家用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。
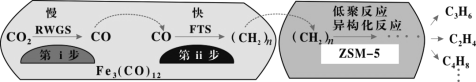
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
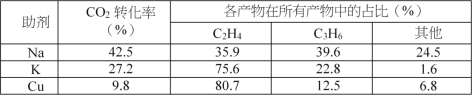
①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加____________助剂效果最好;
②加入助剂能提高单位时间内乙烯产量的根本原因是____________。
(3)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理如右图所示。
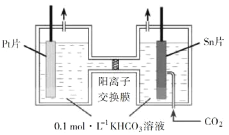
①写出阴极CO2还原为HCOO的电极反应式:________________________。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是_____________________。
【答案】第二周期第ⅣA族 催化剂 CO2![]() C+O2 K 降低生成乙烯的反应所需要的活化能,加快乙烯生成速率,而对其他副反应几乎无影响 CO2+HCO3+2e=HCOO +CO32-或CO2+H++2e=HCOO 阳极产生O2,pH减小,
C+O2 K 降低生成乙烯的反应所需要的活化能,加快乙烯生成速率,而对其他副反应几乎无影响 CO2+HCO3+2e=HCOO +CO32-或CO2+H++2e=HCOO 阳极产生O2,pH减小,![]() 浓度降低,K+部分迁移至阴极区
浓度降低,K+部分迁移至阴极区
【解析】
(1)①碳在元素周期表中的位置为第二周期第ⅣA族。
②由反应原理图可知,过程Ⅰ中FeO是反应物,过程Ⅱ中FeO是生成物。
③CO2转化为炭黑的总反应方程式是二氧化碳在催化剂作用下生成氧气和碳。
(2)①由表中数据可知,Na的其他副反应占比大,Cu的CO2转化率低,兼顾乙烯的产率、CO2转化率和对副反应的影响,选择添加K助剂效果最好,不仅能提高单位时间内乙烯产量,并且其他副反应占比少。
②加入助剂能降低生成乙烯的反应所需要的活化能,加快乙烯生成速率,而对其他副反应几乎无影响。
(3)①阴极发生还原反应,CO2得电子生成HCOO-。
②阳极区OH-失电子产生O2,溶液pH减小,HCO3浓度降低,溶液中的阳离子向阴极移动,K+部分迁移到阴极区。
(1)①碳在元素周期表中的位置为第二周期第ⅣA族,故答案为:第二周期第ⅣA族。
②由反应原理图可知,过程Ⅰ中FeO是反应物,过程Ⅱ中FeO是生成物,整个过程中FeO作催化剂,故答案为:催化剂。
③CO2转化为炭黑的总反应方程式是二氧化碳在催化剂作用下生成氧气和碳,化学反应方程式:CO2![]() C+O2,故答案为:CO2
C+O2,故答案为:CO2![]() C+O2。
C+O2。
(2)①由表中数据可知,Na的其他副反应占比大,Cu的CO2转化率低,兼顾乙烯的产率、CO2转化率和对副反应的影响,选择添加K助剂效果最好,不仅能提高单位时间内乙烯产量,并且其他副反应占比少,故答案为:K。
②加入助剂能提高单位时间内乙烯产量的根本原因是降低生成乙烯的反应所需要的活化能,加快乙烯生成速率,而对其他副反应几乎无影响,故答案为:降低生成乙烯的反应所需要的活化能,加快乙烯生成速率,而对其他副反应几乎无影响。
(3)①阴极发生还原反应,CO2得电子生成HCOO-,阴极的电极反应式为:
CO2+HCO3+2e=HCOO+CO32-或CO2+H++2e=HCOO,故答案为:CO2+HCO3+2e=HCOO+CO32-或CO2+H++2e=HCOO。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,是由于电解质溶液中OH-在阳极失电子产生O2,溶液pH减小,HCO3浓度降低,溶液中的阳离子向阴极移动,K+部分迁移到阴极区,故答案为:阳极产生O2,pH减小,![]() 浓度降低,K+部分迁移至阴极区。
浓度降低,K+部分迁移至阴极区。


 一课一练课时达标系列答案
一课一练课时达标系列答案 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铟(In)主要应用于透明导电图层、荧光材料、有机合成等,以ITO靶材废料(主要由In2O3、SnO2组成)为原料回收铟的工艺流程如图:
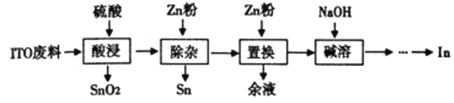
已知:i. 锡、锌的性质均与铝的性质相似.
ii. 铟不与强碱反应,氢氧化铟难与强碱性溶液反应,在较浓的氢氧化钠溶液中也只有少量溶解。
iii. Ksp[In(OH)3]=1×10-33 Ksp[Sn(OH)4]=1×10-56
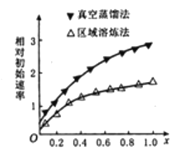
(1)海绵状ITO[xIn2O3(1-x)SnO2]可作异佛尔酮二胺合成的催化剂,如图表示相同条件下,两种不同方法制得的催化剂催化异佛尔酮二胺的相对初始速率随x的变化曲线。真空蒸馏法的相对初始速率较大的原因可能是_________,In2O3、SnO2两种氧化物中,催化效果更好的是__________;
(2)酸浸时,铟的浸出率随温度和硫酸浓度的关系如表,锡的浸出率小于20%。
30℃ | 50℃ | 70℃ | 90℃ | |
3 mol/L H2SO4 | 56% | 72% | 83% | 91% |
4 mol/L H2SO4 | 68% | 81% | 89% | 94% |
①写出“浸出”反应的化学方程式:___________________________;
②由上表信息可得出规律:其他条件不变时,铟的浸出率随温度升高而_____________(填“增大”“减小”或“不变”下同),温度越高,硫酸浓度对铟的浸出率影响__________;
(3)现有一份In2(SO4)3和Sn2(SO4)2的混合溶液,向其中逐渐加入锌粉,测得析出固体的质量随加入锌粉的物质的量关系如图所示:
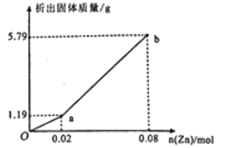
该混合溶液中,In3+和Sn4+的物质的量浓度之比为_______________;
(4)若“浸酸”后的溶液中In2(SO4)3的浓度为1 mol/L,取100 mL该溶液向其中滴加氨水,当Sn4+沉淀完全[设c(Sn4+)=1×10-6 mol/L]时,溶液的pH=____________,此时In3+是否开始形成沉淀_____(填“是”或“否”);
(5)“碱熔”时主要反应的离子方程式为___________;
(6)以粗铟为阳极,纯铟为阴极,H2SO4、NaCl和InCl3混合液为电解液可提纯粗铟。写出阴极反应的电极方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酰奎宁酸具有抗菌、抗病霉作用,其一种合成路线如图:
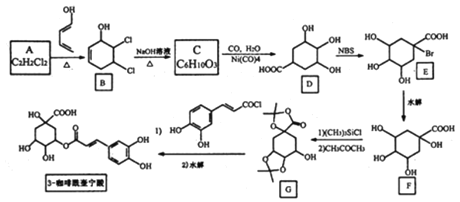
回答下列问题:
(1)A的化学名称是:___________,B中官能团的名称为___________;
(2)A到B、D到E的反应类型依次是____________;
(3)G的分子式为________________;
(4)B生成C的化学方程式为__________;
(5)X是C的同分异构体,其能发生银镜反应和水解反应,核磁共振氢谱有2组峰,且峰面积比为9:1,写出符合题意的X的一种结构简式:____________;
(6)设计以1,3-丁二烯和氯乙烯为起始原料制备 的合成路线:_________(无机试剂任用)。
的合成路线:_________(无机试剂任用)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/LKOH溶液滴定10mL0.1mol/LHA溶液的滴定曲线如图所示。下列说法不正确的是( )
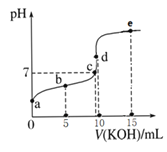
A.a点pH约为3,可以判断HA是弱酸
B.b点溶液:c(A-)>c(K+)>c(HA)>c(H+)>c(OH-)
C.c点溶液:c(K+)=c(A-)
D.水的电离程度:c点>d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产CuCl的工艺如下:
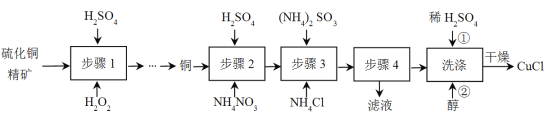
已知CuCl难溶于醇和水,溶于c(Cl-)较大的体系[CuCl(s)+Cl-![]() CuCl2-],潮湿空气中易水解氧化。
CuCl2-],潮湿空气中易水解氧化。
(1)步骤1开始前需要对硫化铜精矿进行粉碎,目的是______;
(2)步骤1是“氧化酸浸”的过程,该过程生成蓝色溶液和浅黄色沉淀,化学方程式是__________________________________;
(3)步骤2是溶解过程,溶解时反应的离子方程式______;
(4)步骤3为主反应,Cu+的沉淀率与加入的NH4Cl的量关系如图所示。
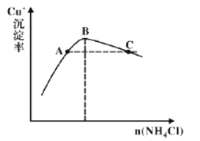
①反应的氧化产物是______;
②比较c(Cu+)相对大小:A点______C点(填“>”、“<”或“=”);
③提高C点状态混合物中Cu+沉淀率的措施是______;
(5)步骤4进行的实验操作是______;
(6)洗涤过程中不能用硝酸代替硫酸进行“酸洗”,理由是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去)。已知下列数据:
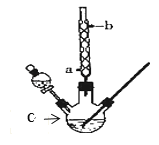
乙醇 | 乙酸 | 乙酸乙酯 | 98%浓硫酸 | |
熔点/℃ | ﹣117.3 | 16.6 | ﹣83.6 | |
沸点/℃ | 78.5 | 117.9 | 77.5 | 338.0 |
请回答下列问题:
(1)仪器C的名称为______,球形冷凝管的作用是_____。
(2)向C中加入反应物,待充分反应后,将C中的混合物倒入装有饱和碳酸钠溶液的烧杯中充分振荡洗涤。饱和碳酸钠溶液作用是(填字母):_____
A.中和乙酸并溶解乙醇
B.碳酸钠溶液呈碱性,有利于乙酸乙酯的水解
C.加速乙酸乙酯的生成,提高其产率
D.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
(3)经多次振荡洗涤、静置分液后,为了进一步提纯乙酸乙酯,可采用蒸馏的方法,蒸馏时控制温度在__左右,温度计的水银球应位于____。
(4)若实验所用乙酸质量为2.4g,乙醇质量为2.1g,得到纯净的产品质量为2.64g,则乙酸乙酯的产率是______。
(5)乙酸乙酯与氢氧化钠溶液发生反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年为“国际化学元素周期表年”。如图所示是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法不正确的是
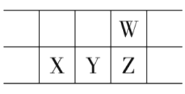
A.原子半径:W<X
B.气态氢化物热稳定性:Z<W
C.Y单质可用做半导体材料
D.X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是______(填字母)。
A.Na2O与水反应 B.甲烷的燃烧反应 C.CaCO3受热分解 D.锌与盐酸反应
(2)获取能量变化的途径
① 通过化学键的键能计算。已知:
化学键种类 | H—H | O=O | O—H |
键能(kJ/mol) | 436 | 498 | 463.4 |
计算可得:2H2(g)+ O2(g) =2H2O(g) H=____________kJ·mol-1
② 通过物质所含能量计算。已知反应中A+B=C+D中A、B、C、D所含能量依次可表示为E A、EB、 EC、 ED,该反应△H=_______。
③ 通过盖斯定律可计算。已知在25℃、101kPa时:
Ⅰ.2Na(s)+![]() O2 (g) =Na2O(s) △H=-414kJ·mol-1
O2 (g) =Na2O(s) △H=-414kJ·mol-1
Ⅱ.2Na(s)+O2(g) =Na2O2(s) △H=-511kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式__________。
④利用实验装置测量。测量盐酸与NaOH溶液反应的热量变化的过程中,若取50 mL 0.50 mol·L-1的盐酸,则还需加入________(填序号)。
A.50 mL 0.50 mol·L-1 NaOH溶液
B.50 mL 0.55 mol·L-1NaOH溶液
C.1.0 g NaOH固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com