
【题目】铟(In)主要应用于透明导电图层、荧光材料、有机合成等,以ITO靶材废料(主要由In2O3、SnO2组成)为原料回收铟的工艺流程如图:
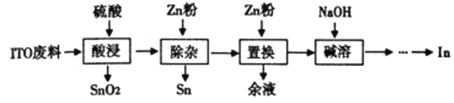
已知:i. 锡、锌的性质均与铝的性质相似.
ii. 铟不与强碱反应,氢氧化铟难与强碱性溶液反应,在较浓的氢氧化钠溶液中也只有少量溶解。
iii. Ksp[In(OH)3]=1×10-33 Ksp[Sn(OH)4]=1×10-56
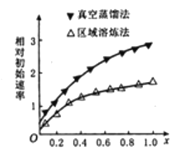
(1)海绵状ITO[xIn2O3(1-x)SnO2]可作异佛尔酮二胺合成的催化剂,如图表示相同条件下,两种不同方法制得的催化剂催化异佛尔酮二胺的相对初始速率随x的变化曲线。真空蒸馏法的相对初始速率较大的原因可能是_________,In2O3、SnO2两种氧化物中,催化效果更好的是__________;
(2)酸浸时,铟的浸出率随温度和硫酸浓度的关系如表,锡的浸出率小于20%。
30℃ | 50℃ | 70℃ | 90℃ | |
3 mol/L H2SO4 | 56% | 72% | 83% | 91% |
4 mol/L H2SO4 | 68% | 81% | 89% | 94% |
①写出“浸出”反应的化学方程式:___________________________;
②由上表信息可得出规律:其他条件不变时,铟的浸出率随温度升高而_____________(填“增大”“减小”或“不变”下同),温度越高,硫酸浓度对铟的浸出率影响__________;
(3)现有一份In2(SO4)3和Sn2(SO4)2的混合溶液,向其中逐渐加入锌粉,测得析出固体的质量随加入锌粉的物质的量关系如图所示:
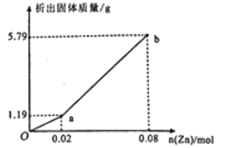
该混合溶液中,In3+和Sn4+的物质的量浓度之比为_______________;
(4)若“浸酸”后的溶液中In2(SO4)3的浓度为1 mol/L,取100 mL该溶液向其中滴加氨水,当Sn4+沉淀完全[设c(Sn4+)=1×10-6 mol/L]时,溶液的pH=____________,此时In3+是否开始形成沉淀_____(填“是”或“否”);
(5)“碱熔”时主要反应的离子方程式为___________;
(6)以粗铟为阳极,纯铟为阴极,H2SO4、NaCl和InCl3混合液为电解液可提纯粗铟。写出阴极反应的电极方程式:___________。
【答案】真空蒸馏法制取得到的催化剂纯度高 In2O3 In2O3+3H2SO4=In2(SO4)3+3H2O、SnO2+2H2SO4=Sn(SO4)2+2H2O 增大 减小 4:1 1.5 否 Zn+2OH-=ZnO22-+H2↑ In3++3e-=In
【解析】
ITO靶材废料(主要由In2O3、SnO2组成)用H2SO4处理,In2O3与硫酸反应产生In2(SO4)3进入溶液,而SnO2有少量反应产生Sn(SO4)2进入溶液,大部分仍以固体形式存在,过滤后除去固体SnO2,向滤液中加入Zn粉,发生反应Sn4++2Zn=Sn+2Zn2+,将反应产生的Sn过滤除去,向滤液中加入Zn粉,发生置换反应:3Zn+2In3+=3Zn2++2In,由于Zn过量,所以过滤,除去滤液,得到的滤渣中含有Zn、In,向滤渣中加入NaOH溶液,发生反应:Zn+2NaOH=Na2ZnO2+H2↑,除去过量Zn单质,得到粗In,然后电解精炼得到精铟。
(1)通过图示可知:在x不变时,真空蒸馏法的相对初始速率较大,可能原因是蒸馏法得到的催化剂中杂质少纯度高,避免了杂质对催化剂催化作用的影响; 在同样条件下,x值越大,相对初始速率越大,说明In2O3的催化效果更好;
(2)①酸浸时In2O3、SnO2与硫酸发生反应,“浸出”反应主要发生:In2O3+3H2SO4=In2(SO4)3+3H2O,此外还发生了反应:SnO2+2H2SO4=Sn(SO4)2+2H2O;
(3)在Oa段发生反应:Sn4++2Zn=Sn+2Zn2+,n(Sn4+)=![]() n(Zn)=
n(Zn)=![]() ×0.02 mol=0.01 mol,在ab段发生反应:3Zn+2In3+=3Zn2++2In,n(In3+)=
×0.02 mol=0.01 mol,在ab段发生反应:3Zn+2In3+=3Zn2++2In,n(In3+)=![]() n(Zn)=
n(Zn)=![]() ×(0.08-0.02) mol=0.04 mol,溶液的体积相同,所以离子浓度比等于它们的物质的量的比,故c(In3+):c(Sn4+)=0.04:0.01=4:1;
×(0.08-0.02) mol=0.04 mol,溶液的体积相同,所以离子浓度比等于它们的物质的量的比,故c(In3+):c(Sn4+)=0.04:0.01=4:1;
(4)由于Ksp[Sn(OH)4]=1×10-56,Ksp[Sn(OH)4]=c(Sn4+)·c4(OH-)=1×10-56,c(Sn4+)=1×10-6mol/L,所以c(OH-)=10-12.5,则c(H+)= =10-1.5,所以此时溶液pH=1.5;由于Ksp[In(OH)3]= =1×10-33,In2(SO4)3的浓度为1 mol/L,则c(In3+)=2 mol/L,而c(OH-)=10-12.5 mol/L,c(In3+)·c3(OH-)=2×(10-12.5)3=2×10-37.5<1×10-33,因此此时In3+不能形成沉淀;
=10-1.5,所以此时溶液pH=1.5;由于Ksp[In(OH)3]= =1×10-33,In2(SO4)3的浓度为1 mol/L,则c(In3+)=2 mol/L,而c(OH-)=10-12.5 mol/L,c(In3+)·c3(OH-)=2×(10-12.5)3=2×10-37.5<1×10-33,因此此时In3+不能形成沉淀;
(5) “碱熔”时NaOH与Zn反应,主要反应的离子方程式为:Zn+2OH-=ZnO22-+H2↑;
(6)以粗铟为阳极,纯铟为阴极,H2SO4、NaCl和InCl3混合液为电解液可提纯粗铟。阳极上In失去电子变为In3+进入溶液,阴极上In3+得到电子变为In单质,阴极的电极方程式为:In3++3e-=In。


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】已知常温下,3种物质的电离平衡常数如下表:
物质 | HCOOH | CH3COOH | NH3·H2O |
电离平衡常数K | 1.77×104 | 1.75×105 | 1.76×105 |
下列说法不正确的是
A.等物质的量浓度时,溶液pH:HCOONa<CH3COONa
B.pH均为3时,溶液浓度:c(HCOOH)>c(CH3COOH)
C.HCOOH溶液与氨水混合,当溶液pH=7时,c(HCOO-)=c(NH4+)
D.等物质的量浓度等体积的CH3COOH溶液和氨水混合,溶液pH约为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.氧化铜与稀硫酸反应:CuO+4H++SO![]() =Cu2++SO2↑+2H2O
=Cu2++SO2↑+2H2O
B.二氧化碳通入足量澄清石灰水中:Ca2++2OH-+CO2=CaCO3↓+H2O
C.铁和盐酸反应:2Fe+6H+=2Fe3++3H2↑
D.氢氧化钡溶液与硫酸反应:OH-+H+=H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),若使固体Mg(OH)2的量减少,而且c(Mg2+)不变,可采取的措施是:
Mg2+(aq)+2OH-(aq),若使固体Mg(OH)2的量减少,而且c(Mg2+)不变,可采取的措施是:
A. 加MgCl2B. 加H2OC. 加NaOHD. 加HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,下列实验用如图所示装置不能完成的是

A.测定一定质量的Cu和Mg混合物中Cu的含量
B.确定分子式为C2H6O的有机物分子中含活泼氢原子的个数
C.比较Fe3+和Cu2+对一定质量的双氧水分解反应的催化效率
D.测定一定质量的Na2SO4·xH2O晶体中结晶水数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中可以说明2HI(g)![]() H2(g)+I2(g)已达到平衡状态的是( )
H2(g)+I2(g)已达到平衡状态的是( )
(1)单位时间内生成n mol H2的同时生成n mol HI
(2)一个H—H键断裂的同时有两个H—I键断裂
(3)c(HI)= c(I2)
(4)反应速率υ(H2)=υ(I2)=0.5υ(HI)
(5)c(H2)∶c(I2)∶c(HI)=2∶1∶1
(6)温度和体积一定时,某一生成物浓度不再变化
(7)温度和体积一定时,容器内压强不再变化
(8)条件一定,混合气体的平均相对分子质量不再变化
(9)温度和体积一定时,混合气体的颜色不再发生变化
(10)温度和压强一定时,混合气体的密度不再发生变化
A. (1)(2)(5)(9)(10) B. (2)(6)(9) C. (6)(7)(10) D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个绝热恒容的密闭容器中分别进行下列两个可逆反应:
甲:C(s)+H2O(g) ![]() CO(g)+H2(g);
CO(g)+H2(g);
乙:CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
现有下列状态:
①混合气体平均相对分子质量不再改变
②气体的总物质的量不再改变
③各气体组成浓度相等
④反应体系中温度保持不变
⑤断裂氢氧键速率是断裂氢氢键速率的2倍
⑥混合气体密度不变
其中能表明甲、乙容器中反应都达到平衡状态的是
A. ①③B. ④⑤C. ③④D. ②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有效控制大气温室气体浓度,推动绿色低碳发展,是人类可持续发展的重要战略之一,因此捕集、利用CO2始终是科学研究的热点。
(1)新的研究表明,可以将CO2转化为炭黑回收利用,反应原理如图所示。
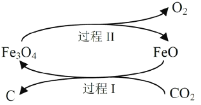
①碳在元素周期表中的位置是_______________。
②整个过程中FeO的作用是__________________。
③写出CO2转化为炭黑的总反应化学方程式__________________。
(2)我国科学家用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。
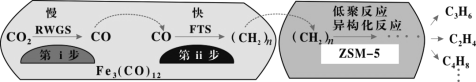
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
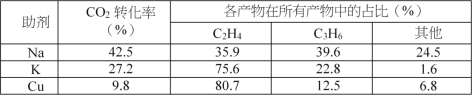
①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加____________助剂效果最好;
②加入助剂能提高单位时间内乙烯产量的根本原因是____________。
(3)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理如右图所示。
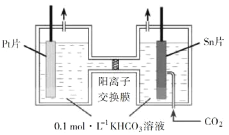
①写出阴极CO2还原为HCOO的电极反应式:________________________。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家正在研究温室气体CH4和CO2的转化和利用。
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为______。
(2)下列关于CH4和CO2的说法正确的是______(填序号)。
a.固态CO2属于分子晶体
b. CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2。
①基态Ni原子的电子排布式为____________,Ni该元素位于元素周期表的第___族。
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有_____molσ键。
(4)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表.CH4与H2O形成的水合物俗称“可燃冰”。
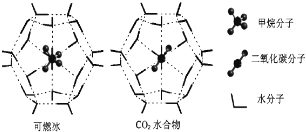
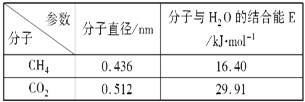
①“可燃冰”中分子间存在的2种作用力是______。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想.已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com