
【题目】已知常温下,3种物质的电离平衡常数如下表:
物质 | HCOOH | CH3COOH | NH3·H2O |
电离平衡常数K | 1.77×104 | 1.75×105 | 1.76×105 |
下列说法不正确的是
A.等物质的量浓度时,溶液pH:HCOONa<CH3COONa
B.pH均为3时,溶液浓度:c(HCOOH)>c(CH3COOH)
C.HCOOH溶液与氨水混合,当溶液pH=7时,c(HCOO-)=c(NH4+)
D.等物质的量浓度等体积的CH3COOH溶液和氨水混合,溶液pH约为7
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】高压直流电线路的瓷绝缘子经常出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,防护原理如图所示。下列说法错误的是( )

A.断电时,牺牲阳极保护法使铁帽不被腐蚀
B.通电时,阳极上的电极反应为Zn-2e-=Zn2+
C.断电时,锌环上的电极反应为Zn-2e-=Zn2+
D.铁帽上加铜环也能防止铁被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 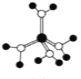 水合铜离子的球棍模型,1个水合铜离子有2个配位键
水合铜离子的球棍模型,1个水合铜离子有2个配位键
B.  冰晶胞示意图,类似金刚石晶胞,冰晶胞内水分子间以共价键结合
冰晶胞示意图,类似金刚石晶胞,冰晶胞内水分子间以共价键结合
C.  H原子的电子云图,由图可见H原子核外靠近核运动的电子多
H原子的电子云图,由图可见H原子核外靠近核运动的电子多
D. 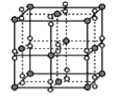 K与氧形成的某化合物晶胞,其中黑球为K+,由图可知该晶体化学式为KO2
K与氧形成的某化合物晶胞,其中黑球为K+,由图可知该晶体化学式为KO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年6月27日,国务院发布《打赢蓝天保卫战三年行动计划》,该计划是中国政府部署的一项污染防治行动计划,旨在持续改善空气质量,为群众留住更多蓝天。对废气的进行必要的处理,让空气更加清洁是环境科学的重要课题。
(1)已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
C (s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
2C (s)+O2(g)=2CO(g) △H3=-221.0kJ/mol
若某反应的平衡常数表达式为![]() ,请写出此反应的热化学方程式_________________。
,请写出此反应的热化学方程式_________________。
(2)用如图所示的电解装置可将雾霾中的NO、SO2分别转化为NH![]() 和SO
和SO![]()
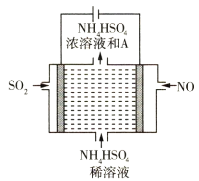
①写出物质A的化学式____________。
②NO在电极上发生的反应为 _________________。
SO2在电极上发生的反应为 __________________。
(3)工业上常用氨水吸收SO2,可生成NH4HSO3和(NH4)2SO3。
①某同学测得氨水吸收SO2所得溶液中NH4HSO3和(NH4)2SO3的物质的量之比恰好为2:1,写出该吸收过程的总反应方程式______________________________________。
②已知常温下H2S的电离常数Ka1=1.3×10-7,Ka2=7.1×10-15,将等物质的量浓度的NaHS与Na2S溶液等体积混合,所得溶液中离子浓度大小顺序为__________________。(用物质的量浓度符号由大到小排列)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁元素在自然界广泛分布,是人体的必需元素之一。回答下列问题
(1)下列Mg原子的核外电子排布式中,能量最高的是_______,能量最低的是________(填序号)
a.1s22s22p43s13px13py13pz1 b.1s22s22p33s23px13py13pz1
c.1s22s22p63s13px1 d.1s22s22p63s2
(2)Mg元素的第一电离能高于Al元素,其原因是_________________________。
(3)MgO是一种耐火材料,熔点2852℃,其熔融物中有Mg2+和O![]() ,这两个离子半径大小关系是_________;MgO的熔点高于MgCl2的原因是__________________。
,这两个离子半径大小关系是_________;MgO的熔点高于MgCl2的原因是__________________。
(4)叶绿素a是自然界中常见的含镁化合物,从叶绿素a的结构看,其中的碳原子既有sp2杂化,又有sp3杂化,以sp2杂化的碳原子有________个,叶绿素a结构中存在_______(填标号)。
a.配位键 b.π键 c.非极性键 d.氢键 e.极性键

(5)尖晶石是镁铝氧化物组成的矿物,有些尖晶石透明且颜色漂亮,可作宝石。如图为尖晶石的一种晶胞,晶胞中有A型和B型两种结构单元。则该尖晶石的化学式为____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
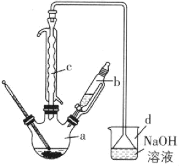
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
物质 | 苯 | 溴 | 溴苯 |
密度/(g·cm-3) | 0.88 | 3.12 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解性 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了___气体。继续滴加至液溴滴完。装置d的作用是___。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是___。
③向分液分离出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是___。
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为___。要进一步提纯,下列操作合理的是___(填序号)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是___(填序号)。
A.25mL B.50mL C.250mL D.509mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铟(In)主要应用于透明导电图层、荧光材料、有机合成等,以ITO靶材废料(主要由In2O3、SnO2组成)为原料回收铟的工艺流程如图:
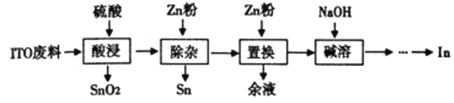
已知:i. 锡、锌的性质均与铝的性质相似.
ii. 铟不与强碱反应,氢氧化铟难与强碱性溶液反应,在较浓的氢氧化钠溶液中也只有少量溶解。
iii. Ksp[In(OH)3]=1×10-33 Ksp[Sn(OH)4]=1×10-56
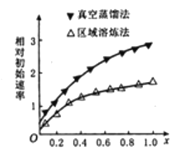
(1)海绵状ITO[xIn2O3(1-x)SnO2]可作异佛尔酮二胺合成的催化剂,如图表示相同条件下,两种不同方法制得的催化剂催化异佛尔酮二胺的相对初始速率随x的变化曲线。真空蒸馏法的相对初始速率较大的原因可能是_________,In2O3、SnO2两种氧化物中,催化效果更好的是__________;
(2)酸浸时,铟的浸出率随温度和硫酸浓度的关系如表,锡的浸出率小于20%。
30℃ | 50℃ | 70℃ | 90℃ | |
3 mol/L H2SO4 | 56% | 72% | 83% | 91% |
4 mol/L H2SO4 | 68% | 81% | 89% | 94% |
①写出“浸出”反应的化学方程式:___________________________;
②由上表信息可得出规律:其他条件不变时,铟的浸出率随温度升高而_____________(填“增大”“减小”或“不变”下同),温度越高,硫酸浓度对铟的浸出率影响__________;
(3)现有一份In2(SO4)3和Sn2(SO4)2的混合溶液,向其中逐渐加入锌粉,测得析出固体的质量随加入锌粉的物质的量关系如图所示:
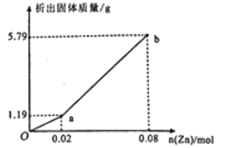
该混合溶液中,In3+和Sn4+的物质的量浓度之比为_______________;
(4)若“浸酸”后的溶液中In2(SO4)3的浓度为1 mol/L,取100 mL该溶液向其中滴加氨水,当Sn4+沉淀完全[设c(Sn4+)=1×10-6 mol/L]时,溶液的pH=____________,此时In3+是否开始形成沉淀_____(填“是”或“否”);
(5)“碱熔”时主要反应的离子方程式为___________;
(6)以粗铟为阳极,纯铟为阴极,H2SO4、NaCl和InCl3混合液为电解液可提纯粗铟。写出阴极反应的电极方程式:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com