
【题目】镁元素在自然界广泛分布,是人体的必需元素之一。回答下列问题
(1)下列Mg原子的核外电子排布式中,能量最高的是_______,能量最低的是________(填序号)
a.1s22s22p43s13px13py13pz1 b.1s22s22p33s23px13py13pz1
c.1s22s22p63s13px1 d.1s22s22p63s2
(2)Mg元素的第一电离能高于Al元素,其原因是_________________________。
(3)MgO是一种耐火材料,熔点2852℃,其熔融物中有Mg2+和O![]() ,这两个离子半径大小关系是_________;MgO的熔点高于MgCl2的原因是__________________。
,这两个离子半径大小关系是_________;MgO的熔点高于MgCl2的原因是__________________。
(4)叶绿素a是自然界中常见的含镁化合物,从叶绿素a的结构看,其中的碳原子既有sp2杂化,又有sp3杂化,以sp2杂化的碳原子有________个,叶绿素a结构中存在_______(填标号)。
a.配位键 b.π键 c.非极性键 d.氢键 e.极性键

(5)尖晶石是镁铝氧化物组成的矿物,有些尖晶石透明且颜色漂亮,可作宝石。如图为尖晶石的一种晶胞,晶胞中有A型和B型两种结构单元。则该尖晶石的化学式为____________。

【答案】b d Mg和Al原子价电子排布式分别为为3s2、3s23p1,Mg的最外层能级处于全满结构较稳定 r(O2-)>r(Mg2+) MgO的晶格能高于MgCl2 25 abce MgAl2O4
【解析】
(1)基态原子具有的能量最低,得到能量后,电子发生跃迁,从低轨道跃迁到高能级的轨道;
(2)Mg元素的最外层电子处于全充满状态,基态Al最外层电子为3s23p1;
(3) Mg2+和O![]() 具有相同的核外电子排布,原子序数越大半径越小;MgO与MgCl2具有相同的电荷数,而氧离子半径小于氯离子;
具有相同的核外电子排布,原子序数越大半径越小;MgO与MgCl2具有相同的电荷数,而氧离子半径小于氯离子;
(4) 从叶绿素a的结构看,存在C=C键、C=O键,且只含有3条键的碳原子共有25个;叶绿素a结构中存在C-H极性键、C-C非极性键、N与Mg之间的配位键,共价键中的第二条键为π键;
(5)根据晶胞结构,一个晶胞中含有4个A、4个B,则A中含有Mg=4![]() +1=
+1=![]() ,O=4;B中Mg=4
,O=4;B中Mg=4![]() =
=![]() ,Al=4,O=4,则Mg、Al、O的个数比=2:4:8;
,Al=4,O=4,则Mg、Al、O的个数比=2:4:8;
(1)基态原子具有的能量最低,得到能量后,电子发生跃迁,从低轨道跃迁到高能级的轨道,能量最高的是b,能量最低的是d;
(2)Mg元素的最外层电子处于全充满状态,基态Al最外层电子为3s23p1,则Mg的第一电离能高于Al元素;
(3) Mg2+和O![]() 具有相同的核外电子排布,原子序数越大半径越小,则r(O2-)>r(Mg2+);MgO与MgCl2具有相同的电荷数,而氧离子半径小于氯离子,则MgO的晶格能大于MgCl2的,则MgO熔点高于MgCl2;
具有相同的核外电子排布,原子序数越大半径越小,则r(O2-)>r(Mg2+);MgO与MgCl2具有相同的电荷数,而氧离子半径小于氯离子,则MgO的晶格能大于MgCl2的,则MgO熔点高于MgCl2;
(4) 从叶绿素a的结构看,存在C=C键、C=O键,且只含有3条键的碳原子共有25个;叶绿素a结构中存在C-H极性键、C-C非极性键、N与Mg之间的配位键,共价键中的第二条键为π键,答案为:25;abce;
(5)根据晶胞结构,一个晶胞中含有4个A、4个B,则A中含有Mg=4![]() +1=
+1=![]() ,O=4;B中Mg=4
,O=4;B中Mg=4![]() =
=![]() ,Al=4,O=4,则Mg、Al、O的个数比=2:4:8,化学式为MgAl2O4;
,Al=4,O=4,则Mg、Al、O的个数比=2:4:8,化学式为MgAl2O4;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】草酸晶体的组成可表示为H2C2O4xH2O,通过下列实验测定x值,步骤如下:
①称取6.30 g草酸晶体配成100 mL水溶液。
②取25.00mL所配草酸溶液置于锥形瓶中,加入适量稀硫酸,用0.5000molL-1KMnO4溶液进行滴定,到达滴定终点时,消耗KMnO4溶液10.02mL。
③重复②步骤2次,消耗KMnO4溶液的体积分别为11.02mL和9.98mL。已知:H2C2O4 +MnO4- +H+ → CO2 ↑+Mn2++H2O (方程式未配平)
(1)步骤①配制草酸溶液时,需用的玻璃仪器:烧杯、玻璃棒和______;
(2)判断到达滴定终点的实验现象是______;
(3)其它操作正确的情况下,以下操作会使测定的x值偏小的是______;
A 滴定管水洗后未用KMnO4溶液润洗
B 锥形瓶用蒸馏水洗净之后,用草酸溶液润洗
C 开始滴定时滴定管尖嘴处有气泡,滴定结束气泡消失
D 滴定终点读数时,俯视滴定管的刻度
(4)根据以上实验数据计算x值 ______。 (写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①SO42中阴离子的立体构型是_____。
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_____。
③氨的沸点_____(填“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。
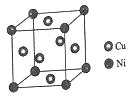
①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水污染的防治、环境污染的治理是化学工作者研究的重要课题,也是践行“绿水青山就是金山银山”的重要举措。在适当的条件下,将CO2转化为甲醚:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH ,既可降低CO2造成的温室效应对环境的影响,还可得到重要的有机产物。
CH3OCH3(g)+3H2O(g) ΔH ,既可降低CO2造成的温室效应对环境的影响,还可得到重要的有机产物。
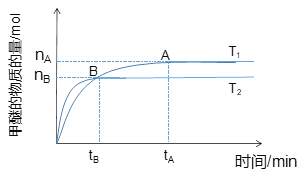
(1)在容积为2 L密闭容器中合成甲醇;其他条件不变的情况下,考察温度对反应的影响,如图所示
①该反应的ΔH________0;ΔS______0(填“>”、“<”或“=”)。
②下列措施可增加甲醚产率的是_____________。
A.升高温度 B.将CH3OCH3(g)从体系中分离
C.使用合适的催化剂 D.充入He,使体系总压强增大
③温度为T1时,从反应开始到平衡,生成甲醚的平均速率为___________________。
(2)一定条件下,向某恒容密闭容器中充入x mol CO2和y mol H2合成甲醚
①下图1中能表示该反应的平衡常数K与温度T之间的变化关系曲线为______(填“a”或“b”)。
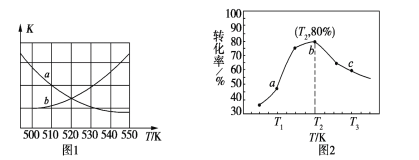
②若x=2、y=3,测得在相同时间内不同温度下H2的转化率如图2所示,则在该时间段内,恰好达到化学平衡时,容器内的压强与反应开始时的压强之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,3种物质的电离平衡常数如下表:
物质 | HCOOH | CH3COOH | NH3·H2O |
电离平衡常数K | 1.77×104 | 1.75×105 | 1.76×105 |
下列说法不正确的是
A.等物质的量浓度时,溶液pH:HCOONa<CH3COONa
B.pH均为3时,溶液浓度:c(HCOOH)>c(CH3COOH)
C.HCOOH溶液与氨水混合,当溶液pH=7时,c(HCOO-)=c(NH4+)
D.等物质的量浓度等体积的CH3COOH溶液和氨水混合,溶液pH约为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以A为原料,经过以下途径可以合成一种重要的制药原料有机物F。
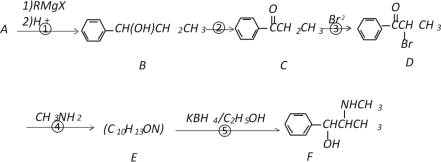
已知:
I.
II.A蒸气的密度是相同条件下氢气密度的53倍。
请回答下列问题:
(1)写出A的结构简式_____________;E中含氧官能团的名称为__________________。
(2)D→E的反应类型是_____________,E→F的反应类型是_________________。
(3)写出反应④的化学反应方程式___________________________________________。
(4)符合下列条件的C的同分异构体有________种(不考虑顺反异构)。
a.苯环上有两个取代基 b.能与NaOH溶液反应 c.分子中含有两种官能团
(5)C的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同的是(_______)(填字母序号)
A.核磁共振仪 B.元素分析仪 C.质谱仪 D.红外光谱仪
(6)以A为原料可以合成高分子化合物G(  ),请设计出合理的合成路线(无机试剂任选)。________________________________________________________________
),请设计出合理的合成路线(无机试剂任选)。________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述中不正确的是 ( )
A. 标准状况下,22.4 L二氯甲烷的分子数约为NA个
B. 常温常压下,7.0 g乙烯与丙烯的混合物中含有氢原子的数目为NA
C. 常温常压下,92 g NO2和N2O4的混合气体中含有的原子总数为6NA
D. 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在科研与生活中有重要作用,某兴趣小组用0.50molL-1 KI、0.2%淀粉溶液、0.20molL-1 K2S2O8、0.10molL-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I-=2SO42-+I2(慢) I2+2S2O32-=2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-) 。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验 | 体积V/mL | ||||
K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx= mL,理由是 。
(3)已知某条件下,浓度c(S2O82-)~反应时间t的变化曲线如图13,若保持其它条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)~反应时间t的变化曲线示意图(进行相应的标注)。
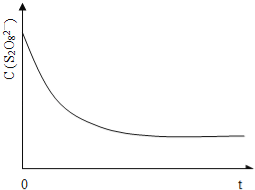
(4)碘也可用作心脏起捕器电源﹣锂碘电池的材料,该电池反应为:2Li(s)+I2(s)=2LiI(s) △H
已知:4Li(s)+O2(g)=2Li2O(s) △H1
4LiI(s)+O2(g)=2I2(s)+2Li2O(s) △H2
则电池反应的△H= ;碘电极作为该电池的 极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中可以说明2HI(g)![]() H2(g)+I2(g)已达到平衡状态的是( )
H2(g)+I2(g)已达到平衡状态的是( )
(1)单位时间内生成n mol H2的同时生成n mol HI
(2)一个H—H键断裂的同时有两个H—I键断裂
(3)c(HI)= c(I2)
(4)反应速率υ(H2)=υ(I2)=0.5υ(HI)
(5)c(H2)∶c(I2)∶c(HI)=2∶1∶1
(6)温度和体积一定时,某一生成物浓度不再变化
(7)温度和体积一定时,容器内压强不再变化
(8)条件一定,混合气体的平均相对分子质量不再变化
(9)温度和体积一定时,混合气体的颜色不再发生变化
(10)温度和压强一定时,混合气体的密度不再发生变化
A. (1)(2)(5)(9)(10) B. (2)(6)(9) C. (6)(7)(10) D. 全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com