
【题目】碘在科研与生活中有重要作用,某兴趣小组用0.50molL-1 KI、0.2%淀粉溶液、0.20molL-1 K2S2O8、0.10molL-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I-=2SO42-+I2(慢) I2+2S2O32-=2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-) 。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验 | 体积V/mL | ||||
K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx= mL,理由是 。
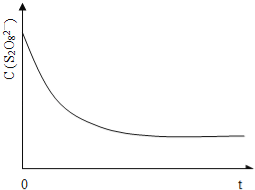
(3)已知某条件下,浓度c(S2O82-)~反应时间t的变化曲线如图13,若保持其它条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)~反应时间t的变化曲线示意图(进行相应的标注)。
(4)碘也可用作心脏起捕器电源﹣锂碘电池的材料,该电池反应为:2Li(s)+I2(s)=2LiI(s) △H
已知:4Li(s)+O2(g)=2Li2O(s) △H1
4LiI(s)+O2(g)=2I2(s)+2Li2O(s) △H2
则电池反应的△H= ;碘电极作为该电池的 极。
【答案】(1)Na2S2O3;<2(2)2;理由是保证其他条件不变,只改变反应物K2S2O8浓度,从而才到达对照实验目的(3)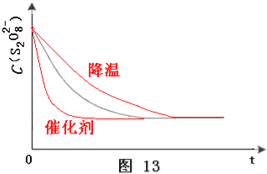 (4)
(4)![]() ;正极
;正极
【解析】
(1)根据KI、Na2S2O3与淀粉的反应原理解答,注意反应过程的快慢问题;
(2)根据实验目的及表格数据分析,从而确定Vx的大小及理由,注意探究物质的量浓度对反应速率影响时,其它条件应相同;
(3)降低温度,化学反应速率减小,则到达平衡时间延长;加入催化剂,增大反应速率,则缩短反应到达平衡时间;
(4)将第一个方程式与第二个方程式相减再除以2,焓变进行相应改变,正极上得电子发生还原反应.
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,先发生S2O82-+2I-═2SO42-+I2(慢),后发生I2+2S2O32-═S4O62-+2I-(快),当S2O32﹣耗尽后,碘才能与淀粉作用显示蓝色,根据I2+2S2O32-═S4O62-+2I-(快)方程式知,I2与S2O32﹣的物质的量的关系为1:2,即1mol碘需2mol S2O32-,根据方程式S2O82-+2I-═2SO42-+I2知,生成1mol碘需为1mol S2O82﹣,即n(S2O32-):n(S2O82-)=2:1,为确保能观察到蓝色,碘需有剩余,即n(S2O32-):n(S2O82﹣)<2;
(1)对照实验1和2发现,实验2取的0.20molL-1 K2S2O8溶液的体积9mL,比实验1少了1mL,说明取的K2S2O8物质的量少,加水1mL,保证了溶液的体积不变,所以在其它条件不变的情况下,探究的是该反应速率与K2S2O8浓度的关系,同样原理对照实验1和3,为保证溶液的体积相同,须加2mL水;
(1)保持其它条件不变,降低温度,反应速率降低,到达液颜色将由无色变成为蓝色的时间变长,而使用催化剂,能加快化学反应速率,所以到达液颜色将由无色变成为蓝色的时间变短,故答案为
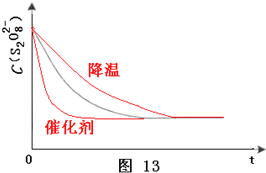 ;
;
(1)①4Li(s)+O2(g)=2Li2O(s) △H1
②4LiI(s)+O2(g)=2I2(s)+2Li2O(s) △H2
将方程式![]() 得2Li(s)+I2(s)=2LiI(s),△H=
得2Li(s)+I2(s)=2LiI(s),△H=![]() ,该反应中碘得电子发生还原反应,所以碘是在正极上发生反应,故答案为
,该反应中碘得电子发生还原反应,所以碘是在正极上发生反应,故答案为![]() ;正极。
;正极。


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是

A. a为负极,是铁片,烧杯中的溶液为硫酸
B. b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C. a为正极,是碳棒,烧杯中的溶液为硫酸
D. b为正极,是碳棒,烧杯中的溶液为硫酸铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁元素在自然界广泛分布,是人体的必需元素之一。回答下列问题
(1)下列Mg原子的核外电子排布式中,能量最高的是_______,能量最低的是________(填序号)
a.1s22s22p43s13px13py13pz1 b.1s22s22p33s23px13py13pz1
c.1s22s22p63s13px1 d.1s22s22p63s2
(2)Mg元素的第一电离能高于Al元素,其原因是_________________________。
(3)MgO是一种耐火材料,熔点2852℃,其熔融物中有Mg2+和O![]() ,这两个离子半径大小关系是_________;MgO的熔点高于MgCl2的原因是__________________。
,这两个离子半径大小关系是_________;MgO的熔点高于MgCl2的原因是__________________。
(4)叶绿素a是自然界中常见的含镁化合物,从叶绿素a的结构看,其中的碳原子既有sp2杂化,又有sp3杂化,以sp2杂化的碳原子有________个,叶绿素a结构中存在_______(填标号)。
a.配位键 b.π键 c.非极性键 d.氢键 e.极性键

(5)尖晶石是镁铝氧化物组成的矿物,有些尖晶石透明且颜色漂亮,可作宝石。如图为尖晶石的一种晶胞,晶胞中有A型和B型两种结构单元。则该尖晶石的化学式为____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃和101 kPa,乙烷、乙炔和丙烯组成的混合烃32 mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72 mL,原混合烃中乙炔的体积分数为( )
A. 15%B. 25%C. 45%D. 75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的少量泥沙和Ca2+、Mg2+、SO![]() 等杂质离子,先将粗盐溶于水,过滤,然后对滤液进行4项操作①过滤②加适量盐酸③加过量的NaOH和Na2CO3混合溶液④加入过量BaCl2溶液。上述4项操作的正确顺序为( )
等杂质离子,先将粗盐溶于水,过滤,然后对滤液进行4项操作①过滤②加适量盐酸③加过量的NaOH和Na2CO3混合溶液④加入过量BaCl2溶液。上述4项操作的正确顺序为( )
A.②①③④B.④②③①
C.④③①②D.②③④①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】已知:①H2(g)+ ![]() O2(g)=2H2O(g) △H1=akJ/mol
O2(g)=2H2O(g) △H1=akJ/mol
②2H2(g)+O2(g)=2H2O(g) △H2=b kJ/mol
③H2(g)+ ![]() O2(g)=H2O(l) △H3=ckJ/mol;
O2(g)=H2O(l) △H3=ckJ/mol;
④2H2(g)+O2(g)=2H2O(l) △H4=dkJ/mol。
下列关系正确的是
A. a<c<0 B. b>d>0 C. 2a=b<0 D. 2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是( )
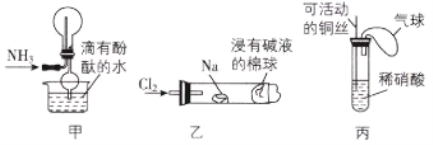
①实验室收集氨气采用图甲所示装置
②实验室中做氯气与钠反应的实验时采用图乙所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图丙所示装置进行铜与稀硝酸的反应
A.②③④B.①②③C.①②④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产CuCl的工艺如下:
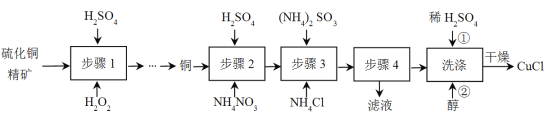
已知CuCl难溶于醇和水,溶于c(Cl-)较大的体系[CuCl(s)+Cl-![]() CuCl2-],潮湿空气中易水解氧化。
CuCl2-],潮湿空气中易水解氧化。
(1)步骤1开始前需要对硫化铜精矿进行粉碎,目的是______;
(2)步骤1是“氧化酸浸”的过程,该过程生成蓝色溶液和浅黄色沉淀,化学方程式是__________________________________;
(3)步骤2是溶解过程,溶解时反应的离子方程式______;
(4)步骤3为主反应,Cu+的沉淀率与加入的NH4Cl的量关系如图所示。
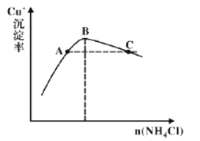
①反应的氧化产物是______;
②比较c(Cu+)相对大小:A点______C点(填“>”、“<”或“=”);
③提高C点状态混合物中Cu+沉淀率的措施是______;
(5)步骤4进行的实验操作是______;
(6)洗涤过程中不能用硝酸代替硫酸进行“酸洗”,理由是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com