
����Ŀ���Ȼ���ͭ(CuCl)�㷺Ӧ����ұ��ҵ��Ҳ����������ɱ����������ͭ����Ϊԭ������CuCl�Ĺ������£�
��֪CuCl�����ڴ���ˮ������c(Cl-)�ϴ����ϵ[CuCl(s)+Cl-![]() CuCl2-]����ʪ��������ˮ��������
CuCl2-]����ʪ��������ˮ��������
��1������1��ʼǰ��Ҫ����ͭ������з��飬Ŀ����______��
��2������1��������������Ĺ��̣��ù���������ɫ��Һ��dz��ɫ��������ѧ����ʽ��__________________________________��
��3������2���ܽ���̣��ܽ�ʱ��Ӧ�����ӷ���ʽ______��
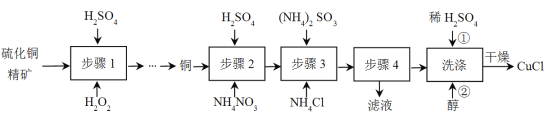
��4������3Ϊ����Ӧ��Cu+�ij�����������NH4Cl������ϵ��ͼ��ʾ��
�ٷ�Ӧ������������______��
�ڱȽ�c(Cu+)��Դ�С��A��______C�㣨����>������<������=������
�����C��״̬�������Cu+�����ʵĴ�ʩ��______��
��5������4���е�ʵ�������______��
��6��ϴ�ӹ����в�����������������������ϴ����������______��
���𰸡�����Ӵ�������ӿ췴Ӧ���ʡ����ͭ�Ľ������ʵȺ����Դ� CuS+H2SO4+H2O2=CuSO4+S+2H2O 3Cu+8H++2NO3-=3Cu2++2NO��+4H2O��Cu+4H++2NO3-=Cu2++2NO2��+2H2O SO42- ��(NH4)2SO4 > ��ˮϡ�� ���� HNO3����ǿ�����Ի��CuCl����
��������
H2O2�����������½�CuS�е�S2-��������S���ʣ��䷴Ӧ����ʽΪ��CuS+H2SO4+H2O2=CuSO4+S+2H2O��CuSO4����ԭ����Cu���ʣ�����NO3-�����������¾���ǿ�����ԣ�������Cu��������Cu2+��Ȼ����ˣ���Һ�м���(NH4)2SO3��NH4Cl����������ԭ��Ӧ����CuCl�������ӷ�Ӧ����ʽΪ��2Cu2++SO32-+2Cl-+H2O=2CuCl��+SO42-+2H+���õ���CuCl��������ϴ�������Ҵ�ϴ�ӣ���ɵõ�CuCl��
��1�������������ǰ�Ƚ�ͭ������Ŀ��������Ӵ�������ӿ�������ʣ����ͭ�Ľ����ʵȣ��ʴ�Ϊ������Ӵ�������ӿ췴Ӧ���ʡ����ͭ�Ľ������ʵȺ����Դ𰸡�
��2���ù���������ɫ��Һ��dz��ɫ������˵����������ͭ�����ʣ�H2O2�����������½�CuS�е�S2-��������S���ʣ��䷴Ӧ�Ļ�ѧ��Ӧ����ʽΪCuS+H2SO4+H2O2=CuSO4+S+2H2O���ʴ�Ϊ��CuS+H2SO4+H2O2=CuSO4+S+2H2O��
��3�����ܽ��������У�����NO3-�����������¾���ǿ�����ԣ�������Cu��������Cu2+�����ӷ�Ӧ����ʽΪ��3Cu+8H++2NO3-=3Cu2++
2NO��+4H2O��Cu+4H++2NO3-=Cu2++2NO2��+2H2O ���ʴ�Ϊ��3Cu+8H++2NO3-=3Cu2++2NO��+4H2O��Cu+4H++2NO3-=Cu2++2NO2��+2H2O ��
��4�����漰��ӦΪ��2Cu2++SO32-+2Cl-+H2O=2CuCl��+SO42-+2H+����Ӧ��SԪ�ػ��ϼ���+4������Ϊ+6�ۣ�����������������ΪSO42-��(NH4)2SO4���ʴ�Ϊ��SO42- ��(NH4)2SO4��
��B��֮ǰCu+��Cl-�γ�CuCl�ij�����B��ʱ������CuCl(s)![]() Cu+(aq)+Cl-(aq)��B��֮��c(Cl-)������CuCl(s)�ܽ⣬[CuCl(s)+Cl-
Cu+(aq)+Cl-(aq)��B��֮��c(Cl-)������CuCl(s)�ܽ⣬[CuCl(s)+Cl-![]() CuCl2-]������ƽ��û�ƶ�������C���B���c(Cu+)��ȣ�����B��֮ǰ��CuCl(s)
CuCl2-]������ƽ��û�ƶ�������C���B���c(Cu+)��ȣ�����B��֮ǰ��CuCl(s)![]() Cu+(aq)+Cl-(aq)ƽ�������ƶ�������A��c(Cu+)����B�㣬��A��c(Cu+)����C�㣬�ʴ�Ϊ��>��
Cu+(aq)+Cl-(aq)ƽ�������ƶ�������A��c(Cu+)����B�㣬��A��c(Cu+)����C�㣬�ʴ�Ϊ��>��
��B��֮��c(Cl-)������CuCl(s)�ܽ⣬����[CuCl(s)+Cl-![]() CuCl2-]���������٣��������C��״̬�������Cu+�����ʣ����Լ�ˮϡ�ͣ�����c(Cl-)���ʴ�Ϊ����ˮϡ�͡�
CuCl2-]���������٣��������C��״̬�������Cu+�����ʣ����Լ�ˮϡ�ͣ�����c(Cl-)���ʴ�Ϊ����ˮϡ�͡�
��5������4�ǹ�Һ���룬���Խ��е�ʵ������ǹ��ˣ��ʴ�Ϊ�����ˡ�
��6���������ǿ�����ԣ�������CuCl������������������ᣬ�ʴ�Ϊ��HNO3����ǿ�����Ի��CuCl������


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ���������������Ҫ���ã�ij��ȤС����0.50molL-1 KI��0.2%������Һ��0.20molL-1 K2S2O8��0.10molL-1 Na2S2O3���Լ���̽����Ӧ�����Ի�ѧ��Ӧ���ʵ�Ӱ�졣
��֪��S2O82-+2I-=2SO42-+I2������ I2+2S2O32-=2I-+S4O62-���죩
��1����KI��Na2S2O3����۵Ļ����Һ�м���һ������K2S2O8��Һ������Һ�е��� ���ľ�����Һ��ɫ������ɫ��Ϊ��ɫ��Ϊȷ���ܹ۲쵽��ɫ��S2O32-��S2O82-��ʼ�����ʵ���������Ĺ�ϵΪ��n(S2O32-)��n(S2O82-)�� ����
��2��Ϊ̽����Ӧ��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬��Ƶ�ʵ�鷽�����±���
ʵ�� | ���V/mL | ||||
K2S2O8��Һ | ˮ | KI��Һ | Na2S2O3��Һ | ������Һ | |
�� | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
�� | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
�� | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
����Vx=�� ��mL���������� ����
��3����֪ij�����£�Ũ��c(S2O82-)����Ӧʱ��t�ı仯������ͼ13�������������������䣬���ڴ������ͼ�У��ֱ����ͷ�Ӧ�¶Ⱥͼ������ʱc(S2O82-)����Ӧʱ��t�ı仯����ʾ��ͼ��������Ӧ�ı�ע����
��4����Ҳ����������������Դ��﮵��صIJ��ϣ��õ�ط�ӦΪ��2Li(s)+I2(s)=2LiI(s) ��H
��֪��4Li(s)+O2(g)=2Li2O(s) ��H1
4LiI(s)+O2(g)=2I2(s)+2Li2O(s) ��H2
���ط�Ӧ����H= ����缫��Ϊ�õ�ص��� ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���п���˵��2HI��g��![]() H2��g��+I2��g���Ѵﵽƽ��״̬���ǣ� ��
H2��g��+I2��g���Ѵﵽƽ��״̬���ǣ� ��
��1����λʱ��������n mol H2��ͬʱ����n mol HI
��2��һ��H��H�����ѵ�ͬʱ������H��I������
��3��c(HI)= c(I2)
��4����Ӧ���ʦ�(H2)=��(I2)=0.5��(HI)
��5��c(H2)��c(I2)��c(HI)=2��1��1
��6���¶Ⱥ����һ��ʱ��ijһ������Ũ�Ȳ��ٱ仯
��7���¶Ⱥ����һ��ʱ��������ѹǿ���ٱ仯
��8������һ������������ƽ����Է����������ٱ仯
��9���¶Ⱥ����һ��ʱ������������ɫ���ٷ����仯
��10���¶Ⱥ�ѹǿһ��ʱ�����������ܶȲ��ٷ����仯
A. ��1����2����5����9����10�� B. ��2����6����9�� C. ��6����7����10�� D. ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͨ���Ȼ�����Һ�������ϲ�������������ʵ���ܵ���������Һ��������Ӱ��ܿ���ܹ۲쵽��������Ϊ�˱������������ij��ѧС�����������ʵ��װ�ã�ʵ������������£�

�������Լ����ú���װ��A�еĶ�����Ϸ���п����ͨ��_______ע��ϡ���ᡢ���������������������뵽����װ�á�
��________�رջ�������װ��D�ĵ��ܲ����ձ��С�
��ͨ��װ��B��________�μ�Ũ���ᣬ������������뵽BaCl2��Һ�У���Һ���ֳ��塣
�ܴ������������������������װ��һ��ʱ�䡣
�ݽ�ʢ��BaCl2��Һ���Թܴ�װ����ȡ������ȥ��Ƥ���ý�ͷ�ι����뵽�����·��μ�˫��ˮ���漴���ְ�ɫ���ǣ��μ�ϡ���Ტ����ɫ���Dz���ʧ��
��жװ�ã���ϴ����������ʣ��ҩƷ��
��ش��������⣺
(1)ʵ�鲽��ٺ͢۵Ŀհ״�ʹ�õ������ֱ�Ϊ__________��__________
(2)װ��C�б���������__________��
(3)ʵ�鲽��ڵIJ���Ϊ__________��
(4)ʵ�鲽��ܵ�Ŀ����__________��
(5)д��ʵ�鲽����Թ��з�����Ӧ�Ļ�ѧ����ʽ��__________��____________��
(6)Ϊ�˱����������������Ϊ��Ӧ��ȡ��Щ��ʩ?���һ����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ч���ƴ�����������Ũ�ȣ��ƶ���ɫ��̼��չ��������ɳ�����չ����Ҫս��֮һ����˲���������CO2ʼ���ǿ�ѧ�о����ȵ㡣
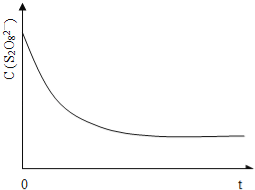
��1���µ��о����������Խ�CO2ת��Ϊ̿�ڻ������ã���Ӧԭ����ͼ��ʾ��
��̼��Ԫ�����ڱ��е�λ����_______________��
������������FeO��������__________________��
��д��CO2ת��Ϊ̿�ڵ��ܷ�Ӧ��ѧ����ʽ__________________��
��2���ҹ���ѧ����Fe3(CO)12/ZSM-5��CO2����ϳɵ�̼ϩ����Ӧ�����ò��ﺬCH4��C3H6��C4H8�ȸ������Ӧ������ͼ��
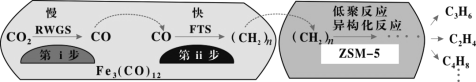
����������Na��K��Cu����������Ҳ������ã��ɸı䷴Ӧ��ѡ���ԣ�������������ͬʱ�����Ӳ�ͬ������������ͬʱ�����CO2ת���ʺ���������ʵ����������±���
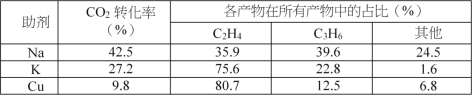
������ߵ�λʱ������ϩ�IJ�������Fe3(CO)12/ZSM-5������____________����Ч����ã�
��������������ߵ�λʱ������ϩ�����ĸ���ԭ����____________��
��3����ⷨת��CO2��ʵ��CO2��Դ�����á����CO2��HCOOH��ԭ������ͼ��ʾ��
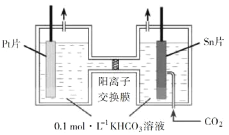
��д������CO2��ԭΪHCOO�ĵ缫��Ӧʽ��________________________��
�����һ��ʱ�����������KHCO3��ҺŨ�Ƚ��ͣ���ԭ����_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ�á���ͼΪ���ʾ��ͼ���õ�ص缫�����һ��ϸС�IJ��ۣ����������������ǿ�������ȶ�����ش�

��1������ȼ�ϵ�ص��ڵ����е����ķ���Ϊ��______(��a��b��ʾ)��
��2��������ӦʽΪ______��������ӦʽΪ___________��
��3���õ�ع���ʱ��H2��O2�������ⲿ����,��ؿ����������ṩ���ܡ���ˣ�������ȫ�����ǹؼ�����֮һ���������һ����Ҫ�Ĵ�����ϣ�����ͷ���ԭ�����£�
�� 2Li+H2![]() 2LiH �� LiH+H2O=LiOH+H2��
2LiH �� LiH+H2O=LiOH+H2��
�ٷ�Ӧ���еĻ�ԭ����_________����Ӧ���е���������_____��
����֪LiH�����ܶ�Ϊ0.82g��cm-3���������224 L(��״��)H2�����ɵ�LiH����뱻���յ�H2�����Ϊ______��
���ɢ����ɵ�LiH��H2O���ã��ų���H2�������ȼ�ϣ�������ת����Ϊ80%��������ͨ�����ӵ����ʵ���Ϊ___mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2016��IUPAC����117��Ԫ��ΪTs����������![]() ����ti��n����Ts��ԭ�Ӻ���������������7������˵������ȷ����
����ti��n����Ts��ԭ�Ӻ���������������7������˵������ȷ����
A.Ts�ǵ������ڵڢ�A��Ԫ��
B.Ts��ͬλ��ԭ�Ӿ�����ͬ�ĵ�����
C.Ts��ͬ��Ԫ���зǽ���������
D.������Ϊ176��Ts���ط�����![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йؾ���������У�����ȷ����
A. �Ȼ�菉����У�ÿ��Cs+��Χ����8��Cl-
B. SiO2����Ϊ�ռ���״�ṹ���ɹ��ۼ��γɵ�ԭ�ӻ��У���С�Ļ�����12��ԭ��
C. �ɱ������У�ÿ��CO2������Χ����12��CO2����
D. ����ͭ�����������ܶѻ��ṹ������þ���������������ܶѻ��ṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SO2�Ǵ����е��к����ʣ���Ҫ��������ۺ����������á�
��1����ҵ�ϳ��ð�ˮ���շ�����SO2��������(NH4)2SO3��NH4HSO3��
�� (NH4)2SO3�Լ��ԣ��û�ѧƽ��ԭ��������ԭ��____________��
�� NH4HSO3�����ԡ��ð�ˮ����SO2��������Һ������ʱ����Һ������Ũ�ȹ�ϵ��ȷ����____������ĸ����
a��c(NH4+)��2c(SO32-)��c(HSO3-)
b��c(NH4+)��c(SO32-)> c(H+)��c(OH��)
c��c(NH4+)��c(H+)��c(SO32-) ��c(HSO3-)��c(OH��)
��2��ij������������Ҫ��SO2��CO2���ڽϸ��¶Ⱦ���ͼ��ʾ�����ѳ�SO2�����Ƶ�H2SO4��
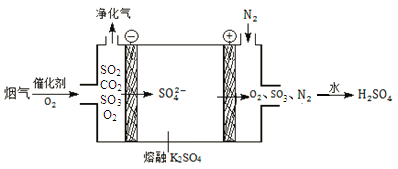
���������ŵ��������_______��
������������SO3�ĵ缫��Ӧʽ��______��
��2�����������SO2�ѳ��ʵIJ������£�
a����һ�����ľ�����������SO3��ͨ������NaOH��Һ���ټ���������ˮ��
b������Ũ���ᣬ������Һ����ɫ�����ݣ��ټ�������BaCl2��Һ��
c�����ˡ�ϴ�ӡ������������������
�������ӷ���ʽ��ʾa����ˮ����Ҫ����________________��
��������������Խ��˵��SO2���ѳ���Խ_____����������������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com