
����Ŀ������ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ�á���ͼΪ���ʾ��ͼ���õ�ص缫�����һ��ϸС�IJ��ۣ����������������ǿ�������ȶ�����ش�

��1������ȼ�ϵ�ص��ڵ����е����ķ���Ϊ��______(��a��b��ʾ)��
��2��������ӦʽΪ______��������ӦʽΪ___________��
��3���õ�ع���ʱ��H2��O2�������ⲿ����,��ؿ����������ṩ���ܡ���ˣ�������ȫ�����ǹؼ�����֮һ���������һ����Ҫ�Ĵ�����ϣ�����ͷ���ԭ�����£�
�� 2Li+H2![]() 2LiH �� LiH+H2O=LiOH+H2��
2LiH �� LiH+H2O=LiOH+H2��
�ٷ�Ӧ���еĻ�ԭ����_________����Ӧ���е���������_____��
����֪LiH�����ܶ�Ϊ0.82g��cm-3���������224 L(��״��)H2�����ɵ�LiH����뱻���յ�H2�����Ϊ______��
���ɢ����ɵ�LiH��H2O���ã��ų���H2�������ȼ�ϣ�������ת����Ϊ80%��������ͨ�����ӵ����ʵ���Ϊ___mol��
���𰸡���b��a 2H2+4OH--4e-=4H2O��H2+2OH--2e-=2H2O O2 + 2H2O + 4e-=4OH- Li H2O ![]() ��8.71��10-4 32
��8.71��10-4 32
��������
(1)ԭ�����Ҫ�ǽ���ѧ��ת��Ϊ���ܣ�����ʧȥ���ӣ�Ϊ����,������õ��ӣ�Ϊ�����������ɸ���ͨ����������������
(2)����������ʧ���Ӻ����������ӷ�Ӧ����ˮ��
(3)�ٸ��ݻ��ϼ۵ı仯�жϣ�����LiH������ΪvL��������������ʵ�������������������۸���ʵ�ʲμӷ�Ӧ�������Լ��缫��Ӧʽ���㡣
(1)ȼ�ϵ����ԭ��أ��ǽ���ѧ��ת��Ϊ���ܵ�װ�ã�����ʧȥ���ӣ�Ϊ������������õ��ӣ�Ϊ�����������ɸ���ͨ��������������������a��b��
(2)����������ʧ���Ӻ����������ӷ�Ӧ����ˮ���缫��ӦʽΪ2H2+4OH--4e-=4H2O��H2+2OH--2e-=2H2O������Ϊ�����õ����ӣ����ڵ������ҺΪ���ԣ������õ����Ӻ�ˮ����OH-������ʽΪO2 + 2H2O + 4e-=4OH-��
(3) 2Li+H2![]() 2LiH���⻯��У�Li�Ļ��ϼ�Ϊ+1����Ӧ���ʧ���ӷ���������Ӧ����ǻ�ԭ������ LiH+H2OLiOH+H2�����÷�Ӧ��H2O�õ�������������������ԭ��Ӧ��H2O����������
2LiH���⻯��У�Li�Ļ��ϼ�Ϊ+1����Ӧ���ʧ���ӷ���������Ӧ����ǻ�ԭ������ LiH+H2OLiOH+H2�����÷�Ӧ��H2O�õ�������������������ԭ��Ӧ��H2O����������
�ڸ��ݻ�ѧ��Ӧ����ʽ��2n(H2)=n(LiH)���������224 LH2��Ϊ10mol�������ɵ�LiHΪ20mol��������Ϊ20mol��(7��1)=160g��![]() �����ɵ�LiH����뱻���յ�H2�����Ϊ195cm3:224L��8.7��10��4��
�����ɵ�LiH����뱻���յ�H2�����Ϊ195cm3:224L��8.7��10��4��
��20molLiH��������20molH2��ʵ�ʲμӷ�Ӧ��H2Ϊ20mol%80%=16mol��1molH2ת��Ϊ1molH2O��ת��2mol���ӣ�����16molH2��ת��32mol�ĵ��ӡ�


 ���ĺ����Ͼ�������ϵ�д�
���ĺ����Ͼ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˳�ȥ�����е�������ɳ��Ca2+��Mg2+��SO![]() ���������ӣ��Ƚ���������ˮ�����ˣ�Ȼ�����Һ����4������ٹ��ˢڼ���������ۼӹ�����NaOH��Na2CO3�����Һ�ܼ������BaCl2��Һ������4���������ȷ˳��Ϊ�� ��
���������ӣ��Ƚ���������ˮ�����ˣ�Ȼ�����Һ����4������ٹ��ˢڼ���������ۼӹ�����NaOH��Na2CO3�����Һ�ܼ������BaCl2��Һ������4���������ȷ˳��Ϊ�� ��
A.�ڢ٢ۢ�B.�ܢڢۢ�
C.�ܢۢ٢�D.�ڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ��BaSO4��ˮ�еij����ܽ�ƽ��������ͼ��ʾ������˵����ȷ����

A. ����Na2SO4��ʹ��Һ��a��䵽b��
B. ͨ����������ʹ��Һ��d��䵽c��
C. d����BaSO4��������
D. a���Ӧ��Ksp����c���Ӧ��Ksp
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)0.3 mol����̬����ȼ��������(B2H6)��������ȼ�գ����ɹ�̬�������������Һ̬ˮ���ų�649.5 kJ���������Ȼ�ѧ����ʽΪ____��
(2)�����ٷɻ���ƽ�������ʱ��β���е�NO���ƻ������㡣��ѧ�������о����ô�������β���е�NO��COת���CO2��N2����ѧ����ʽΪ2NO��2CO![]() 2CO2��N2��Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��������崫������ò�ͬʱ���NO��COŨ�������
2CO2��N2��Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��������崫������ò�ͬʱ���NO��COŨ�������
ʱ��/s | 0 | 1 | 2 |
c(NO)/ mol��L��1 | 1.00��10��3 | 4.50��10��4 | 2.50��10��4 |
c(CO)/mol��L��1 | 3.60��10��3 | 3.05��10��3 | 2.85��10��3 |
ʱ��/s | 3 | 4 | 5 |
c(NO)/ mol��L��1 | 1.50��10��4 | 1.00��10��4 | 1.00��10��4 |
c(CO)/ mol��L��1 | 2.75��10��3 | 2.70��10��3 | 2.70��10��3 |
��ش��������⣺
��ǰ2s�ڵ�ƽ����Ӧ������(N2)��____��
�����������£��÷�Ӧ��ƽ�ⳣ��Ϊ____��
�����������£����ijʱ�̷�Ӧ��ϵ�и����ʵ����ʵ���Ũ�Ⱦ�Ϊ0.01 mol/L�����ʱ��Ӧ����____״̬��(����ƽ�����������ҽ������������������)
(3)ʵ���ҳ���0.10 mol/L KMnO4��������Һ���ⶨH2C2O4��Ʒ�Ĵ���(��Һ�δ���Һ)���䷴Ӧԭ��Ϊ��5H2C2O4��2MnO4����6H��=10CO2����2Mn2+��8H2O��
��KMnO4��ҺӦװ��____(������ʽ��������ʽ��)�ζ��ܣ�
�� ��ˮϴ���ζ��ܺ�ֱ��װ���Һ����ⶨ�����____��(����ƫ��������ƫС������������)
�� �ζ������з���һ��ʱ���Ӧ�������Լӿ죬��ȥ�¶ȵ�Ӱ�죬����Ϊ���п��ܵ�ԭ����____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���ͭ(CuCl)�㷺Ӧ����ұ��ҵ��Ҳ����������ɱ����������ͭ����Ϊԭ������CuCl�Ĺ������£�
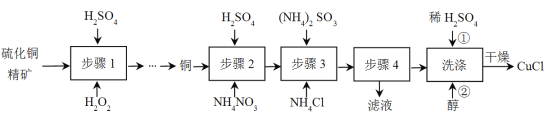
��֪CuCl�����ڴ���ˮ������c(Cl-)�ϴ����ϵ[CuCl(s)+Cl-![]() CuCl2-]����ʪ��������ˮ��������
CuCl2-]����ʪ��������ˮ��������
��1������1��ʼǰ��Ҫ����ͭ������з��飬Ŀ����______��
��2������1��������������Ĺ��̣��ù���������ɫ��Һ��dz��ɫ��������ѧ����ʽ��__________________________________��
��3������2���ܽ���̣��ܽ�ʱ��Ӧ�����ӷ���ʽ______��
��4������3Ϊ����Ӧ��Cu+�ij�����������NH4Cl������ϵ��ͼ��ʾ��
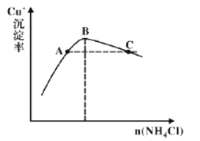
�ٷ�Ӧ������������______��
�ڱȽ�c(Cu+)��Դ�С��A��______C�㣨����>������<������=������
�����C��״̬�������Cu+�����ʵĴ�ʩ��______��
��5������4���е�ʵ�������______��
��6��ϴ�ӹ����в�����������������������ϴ����������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������H2��N2����ȼ�ϵ�أ��Թ̵�øΪ�����������⻯øΪ���������������������¼�ʵ�ֺϳ�NH3��ͬʱ����õ��ܣ��乤��ԭ������ͼ��ʾ��
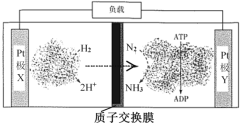
������������ȷ����
A.��װ���ǽ���ѧ��ת��Ϊ����
B.������Ӧ��N2+6e-+6H+ = 2NH3
C.��ع���ʱH2�ڸ���������ԭ��Ӧ
D.������X���徭������Y����Ǩ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������߱�ʾ±��Ԫ��ij��������˵�����ı仯���ƣ���ȷ����
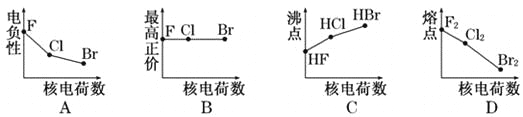
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Li4Ti5O12��LiFePO4��������ӵ�صĵ缫���ϣ���������������Ҫ�ɷ�ΪFeTiO3������������MgO��SiO2�����ʣ����Ʊ��������������£�
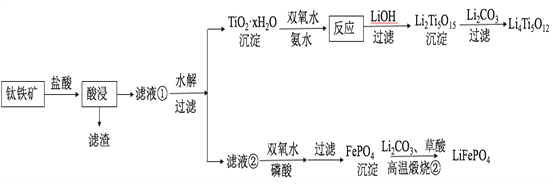
�ش��������⣺
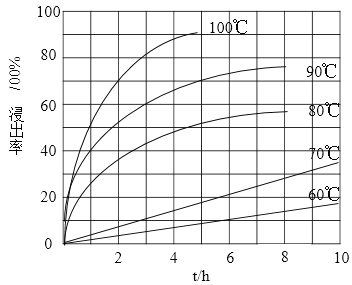
��1���������ʵ���У����Ľ����ʽ������ͼ��ʾ����ͼ��֪�������ľ�����Ϊ70%ʱ�������õ�ʵ������Ϊ___________________��
��2���������������Ҫ��TiOCl42����ʽ���ڣ�д����Ӧ��Ӧ�����ӷ���ʽ__________________��
��3��TiO2��xH2O������˫��ˮ����ˮ��Ӧ40 min����ʵ�������±���ʾ��
�¶�/�� | 30 | 35 | 40 | 45 | 50 |
TiO2��xH2Oת����% | 92 | 95 | 97 | 93 | 88 |
����40��ʱTiO2��xH2Oת������ߵ�ԭ��__________________��
��4��Li2Ti5O15��Ti�Ļ��ϼ�Ϊ+4�����й���������ĿΪ__________________��
��5��������Һ�ڡ���c(Mg2+)=0.02 mol/L������˫��ˮ�����ᣨ����Һ�������1������ʹFe3+ǡ�ó�����ȫ����Һ��c(Fe3+)=1��10-5 mol/L����ʱ�Ƿ���Mg3(PO4)2�������ɣ�___________����ʽ���㣩��
FePO4��Mg3(PO4)2��Ksp�ֱ�Ϊ1.3��10-22��1.0��10-24��
��6��д�����������բڡ�����FePO4�Ʊ�LiFePO4�Ļ�ѧ����ʽ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���飨As���ǵ������ڢ�A��Ԫ�أ������γ�As2O3��As2O5��H3AsO3��H3AsO4�Ȼ�������Ź㷺����;���ش��������⣺
��1���������ԭ�ӽṹʾ��ͼ____________��
��2����ҵ�ϳ��������������Ҫ�ɷ�ΪAs2S3���Ƴɽ�״��ͨ��O2����������H3AsO4�͵�����д��������Ӧ�Ļ�ѧ����ʽ________���÷�Ӧ��Ҫ�ڼ�ѹ�½��У�ԭ����________��
��3����֪��As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ��H1
H2(g)+2O2(g)=H3AsO4(s) ��H1
H2(g)+![]() O2(g)=H2O(l) ��H2
O2(g)=H2O(l) ��H2
2As(s)+![]() O2(g) =As2O5(s) ��H3
O2(g) =As2O5(s) ��H3
��ӦAs2O5(s) +3H2O(l)= 2H3AsO4(s)�Ħ�H =_________��
��4��298 Kʱ����20 mL 3x mol��L1 Na3AsO3��20 mL 3x mol��L1 I2��20 mL NaOH��Һ��ϣ�������Ӧ��AsO33(aq)+I2(aq)+2OH![]() AsO43(aq)+2I(aq)+ H2O(l)����Һ��c(AsO43)�뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ��
AsO43(aq)+2I(aq)+ H2O(l)����Һ��c(AsO43)�뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ��

�����п��жϷ�Ӧ�ﵽƽ�����__________�����ţ���
a.��Һ��pH���ٱ仯
b.v(I)=2v(AsO33)
c. c (AsO43)/c (AsO33)���ٱ仯
d. c(I)=y mol��L1
��tmʱ��v��_____ v��������ڡ���С�ڡ����ڡ�����
��tmʱv��_____ tnʱv��������ڡ���С�ڡ����ڡ�����������_____________��
����ƽ��ʱ��Һ��pH=14����÷�Ӧ��ƽ�ⳣ��KΪ___________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com