
【题目】为了除去粗盐中的少量泥沙和Ca2+、Mg2+、SO![]() 等杂质离子,先将粗盐溶于水,过滤,然后对滤液进行4项操作①过滤②加适量盐酸③加过量的NaOH和Na2CO3混合溶液④加入过量BaCl2溶液。上述4项操作的正确顺序为( )
等杂质离子,先将粗盐溶于水,过滤,然后对滤液进行4项操作①过滤②加适量盐酸③加过量的NaOH和Na2CO3混合溶液④加入过量BaCl2溶液。上述4项操作的正确顺序为( )
A.②①③④B.④②③①
C.④③①②D.②③④①
科目:高中化学 来源: 题型:
【题目】已知25℃时,H2SO3 的电离常数Ka1=1.23![]() 10-2,Ka2=5.6
10-2,Ka2=5.6![]() 10-8,HClO的电离常数Ka=2.98
10-8,HClO的电离常数Ka=2.98![]() 10-8,下列说法错误的是
10-8,下列说法错误的是
A. 常温下,相同浓度的H2SO3 比HClO酸性强
B. 常温下,将NaHSO3溶液滴入到NaClO溶液中发生反应:HSO3-+ClO-=SO32-+HClO
C. 常温下,NaHSO3溶液中HSO3-的电离程度大于其水解程度,NaHSO3溶液呈酸性
D. 将pH=5的HClO溶液加水稀释到pH=6时,溶液中部分离子浓度会升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以A为原料,经过以下途径可以合成一种重要的制药原料有机物F。
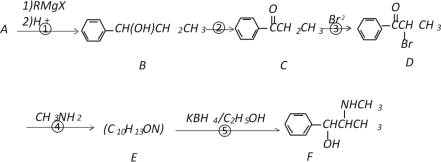
已知:
I.
II.A蒸气的密度是相同条件下氢气密度的53倍。
请回答下列问题:
(1)写出A的结构简式_____________;E中含氧官能团的名称为__________________。
(2)D→E的反应类型是_____________,E→F的反应类型是_________________。
(3)写出反应④的化学反应方程式___________________________________________。
(4)符合下列条件的C的同分异构体有________种(不考虑顺反异构)。
a.苯环上有两个取代基 b.能与NaOH溶液反应 c.分子中含有两种官能团
(5)C的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同的是(_______)(填字母序号)
A.核磁共振仪 B.元素分析仪 C.质谱仪 D.红外光谱仪
(6)以A为原料可以合成高分子化合物G(  ),请设计出合理的合成路线(无机试剂任选)。________________________________________________________________
),请设计出合理的合成路线(无机试剂任选)。________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究酸化条件对0.1mol/LKI溶液氧化反应的影响。
序号 | 操作及现象 |
实验1 | 取放置一段时间后依然无色的0.1mol/LKI溶液,加入淀粉溶液,溶液不变蓝;向溶液中继续加入2滴6mol/L的稀硫酸,溶液立即变蓝 |
实验2 | 取新制的0.1mol/LKI溶液,加入淀粉溶液,溶液不变蓝;向溶液中继续加入2滴6mol/L的稀硫酸,溶液10s后微弱变蓝 |
(1)溶液变蓝,说明溶液中含有____________ 。结合实验1和实验2,该小组同学认为酸化能够加快I-氧化反应的速率。
(2)同学甲对滴加稀硫酸后溶液变蓝速率不同的原因提出猜想:放置一段时间后的0.1mol/LKI溶液成分与新制0.1mol/LKI溶液可能存在差异,并继续进行探究。
实验3:取新制0.1mol/LKI溶液在空气中放置,测得pH如下:
时间 | 5分钟 | 1天 | 3天 | 10天 |
pH | 7.2 | 7.4 | 7.8 | 8.7 |
资料:
ⅰ.pH<11.7时,I-能被O2氧化为I。
ⅱ.一定碱性条件下,I2容易发生歧化,产物中氧化产物与还原产物的物质的量之比为1∶5。
①用化学用语,解释0.1mol/LKI溶液放置初期pH升高的原因:_________________________________________________________。
②对比实验1和实验2,结合化学用语和必要的文字,分析实验1中加稀硫酸后“溶液立即变蓝”的主要原因可能是_____________________________________________________________________________________。
(3)同学甲进一步设计实验验证分析的合理性。
序号 | 操作 | 现象 |
实验4 | 重复实验2操作后,继续向溶液中加入 ________________。 | 溶液立即变蓝 |
(4)该组同学想进一步探究pH对I2发生歧化反应的影响,进行了如下实验。
实验5:用20mL 4种不同浓度的KOH溶液与2mL淀粉溶液进行混合,测量混合液的pH后,向其中加入2滴饱和碘水,观察现象。记录如下:
实验组 | A | B | C | D |
pH | 11.4 | 10.6 | 9.5 | 8.4 |
现象 | 无颜色变化 | 产生蓝色后瞬间消失 | 产生蓝色,30s后蓝色消失 | |
从实验5可以看出pH越大,歧化反应速率越_______________(填“快”或“慢”)。
解释pH=8.4时,“产生蓝色,30s后蓝色消失”的原因:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在科研与生活中有重要作用,某兴趣小组用0.50molL-1 KI、0.2%淀粉溶液、0.20molL-1 K2S2O8、0.10molL-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I-=2SO42-+I2(慢) I2+2S2O32-=2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-) 。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验 | 体积V/mL | ||||
K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx= mL,理由是 。
(3)已知某条件下,浓度c(S2O82-)~反应时间t的变化曲线如图13,若保持其它条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)~反应时间t的变化曲线示意图(进行相应的标注)。
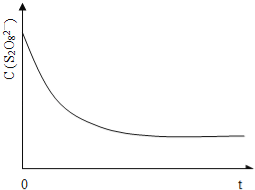
(4)碘也可用作心脏起捕器电源﹣锂碘电池的材料,该电池反应为:2Li(s)+I2(s)=2LiI(s) △H
已知:4Li(s)+O2(g)=2Li2O(s) △H1
4LiI(s)+O2(g)=2I2(s)+2Li2O(s) △H2
则电池反应的△H= ;碘电极作为该电池的 极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物HIn在水溶液中因存在以下电离平衡HIn(aq,红色) ![]() H+(aq)+ In-(aq,黄色)故可作酸碱指示剂。浓度为0.02mol/L的下列溶液:① 盐酸 ② 石灰水 ③ NaCl溶液 ④ NaHSO4溶液 ⑤ NaHCO3溶液 ⑥ 氨水,其中能使指示剂显红色的是
H+(aq)+ In-(aq,黄色)故可作酸碱指示剂。浓度为0.02mol/L的下列溶液:① 盐酸 ② 石灰水 ③ NaCl溶液 ④ NaHSO4溶液 ⑤ NaHCO3溶液 ⑥ 氨水,其中能使指示剂显红色的是
A. ④⑤B. ③⑤C. ①④D. ②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2O(g)=H2O(l) ΔH=Q1 kJ·mol-1
C2H5OH(g)=C2H5OH(l)ΔH=Q2 kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)ΔH=Q3 kJ·mol-1
若使46 g液体酒精完全燃烧,最后恢复到室温,则放出的热量为
A. -(3Q1-Q2+Q3) kJB. -0.5(Q1+Q2+Q3) kJ
C. -(0.5Q1-1.5Q2+0.5Q3) kJD. -(Q1+Q2+Q3) kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:

(1)氢氧燃料电池的在导线中电流的方向为由______(用a、b表示)。
(2)负极反应式为______,正极反应式为___________。
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ 2Li+H2![]() 2LiH Ⅱ LiH+H2O=LiOH+H2↑
2LiH Ⅱ LiH+H2O=LiOH+H2↑
①反应Ⅰ中的还原剂是_________,反应Ⅱ中的氧化剂是_____。
②已知LiH固体密度为0.82g·cm-3,用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为______。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为___mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com