
【题目】某小组探究酸化条件对0.1mol/LKI溶液氧化反应的影响。
序号 | 操作及现象 |
实验1 | 取放置一段时间后依然无色的0.1mol/LKI溶液,加入淀粉溶液,溶液不变蓝;向溶液中继续加入2滴6mol/L的稀硫酸,溶液立即变蓝 |
实验2 | 取新制的0.1mol/LKI溶液,加入淀粉溶液,溶液不变蓝;向溶液中继续加入2滴6mol/L的稀硫酸,溶液10s后微弱变蓝 |
(1)溶液变蓝,说明溶液中含有____________ 。结合实验1和实验2,该小组同学认为酸化能够加快I-氧化反应的速率。
(2)同学甲对滴加稀硫酸后溶液变蓝速率不同的原因提出猜想:放置一段时间后的0.1mol/LKI溶液成分与新制0.1mol/LKI溶液可能存在差异,并继续进行探究。
实验3:取新制0.1mol/LKI溶液在空气中放置,测得pH如下:
时间 | 5分钟 | 1天 | 3天 | 10天 |
pH | 7.2 | 7.4 | 7.8 | 8.7 |
资料:
ⅰ.pH<11.7时,I-能被O2氧化为I。
ⅱ.一定碱性条件下,I2容易发生歧化,产物中氧化产物与还原产物的物质的量之比为1∶5。
①用化学用语,解释0.1mol/LKI溶液放置初期pH升高的原因:_________________________________________________________。
②对比实验1和实验2,结合化学用语和必要的文字,分析实验1中加稀硫酸后“溶液立即变蓝”的主要原因可能是_____________________________________________________________________________________。
(3)同学甲进一步设计实验验证分析的合理性。
序号 | 操作 | 现象 |
实验4 | 重复实验2操作后,继续向溶液中加入 ________________。 | 溶液立即变蓝 |
(4)该组同学想进一步探究pH对I2发生歧化反应的影响,进行了如下实验。
实验5:用20mL 4种不同浓度的KOH溶液与2mL淀粉溶液进行混合,测量混合液的pH后,向其中加入2滴饱和碘水,观察现象。记录如下:
实验组 | A | B | C | D |
pH | 11.4 | 10.6 | 9.5 | 8.4 |
现象 | 无颜色变化 | 产生蓝色后瞬间消失 | 产生蓝色,30s后蓝色消失 | |
从实验5可以看出pH越大,歧化反应速率越_______________(填“快”或“慢”)。
解释pH=8.4时,“产生蓝色,30s后蓝色消失”的原因:_________________________。
【答案】I2或碘单质 2H2O+4I-+O2=2I2+4OH- IO3-+5I-+6H+=3H2O+3I2,该反应的速度快 少量KIO3固体 快 pH=8.4时,同时发生了:碘与淀粉变蓝和碘单质与氢氧化钾的歧化反应。由于碘与淀粉变蓝反应快,所以先产生蓝色,随着歧化反应的进行,碘单质浓度降低,蓝色消失
【解析】
由题可知,pH<11.7时,I-可被O2氧化为I2,通过书写反应的方程式可知,这会导致溶液的碱性逐渐增强;又因为,一定碱性条件下,I2容易发生歧化反应,生成![]() 和I-;那么长时间放置KI溶液,溶液中会含有
和I-;那么长时间放置KI溶液,溶液中会含有![]() 和I-,这两种离子发生归中反应生成I2的速率较快,应该就是实验1中酸化后溶液更迅速变蓝的原因。为了进一步验证上述猜想,设计实验4时,就要验证
和I-,这两种离子发生归中反应生成I2的速率较快,应该就是实验1中酸化后溶液更迅速变蓝的原因。为了进一步验证上述猜想,设计实验4时,就要验证![]() 的存在对于溶液变蓝速率的影响。实验5的设计是为了验证pH对I2歧化速率的影响,分析几组平行实验的现象差异即可得出相关的结论。
的存在对于溶液变蓝速率的影响。实验5的设计是为了验证pH对I2歧化速率的影响,分析几组平行实验的现象差异即可得出相关的结论。
(1)淀粉遇I2会变蓝,因此溶液变蓝说明其中含有I2;
(2)①由题可知,pH<11.7时,I-可被O2氧化,所以反应初期pH升高,相关的方程式为:![]() ;
;
②通过分析可知,相比于实验2,实验1中的溶液加酸后迅速变蓝,原因是![]() 的反应速率更快;
的反应速率更快;
(3)通过分析可知,为了验证题目(2)②的猜想,需要向溶液中加入KIO3固体;
(4)通过分析四组平行实验的现象差异可知,pH越大,歧化反应速率越大,加入碘水后越难观察到溶液变蓝的现象;pH=8.4时,溶液先产生蓝色,是因为碘单质与淀粉相互作用导致的,在较弱的碱性条件下,I2的歧化反应进行的较慢,因此经过一段时间后,I2逐渐歧化反应消耗完全,蓝色才逐渐褪去。


科目:高中化学 来源: 题型:
【题目】某芳香烃A是有机合成中重要的原料,由A制取高聚物M的流程如下:
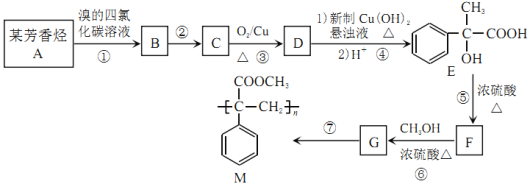
请回答下列问题:
(1)反应②的反应类型为___________。
(2)E中的官能团名称是___________。
(3)反应②的条件是___________。
(4)写出A和F的结构简式:A___________;F___________。
(5)符合下列条件的E的同分异构体有___________种(不考虑立体异构)。
①含有相同官能团
②遇FeCl2能发生显色反应
③苯环上连有三个取代基
(6)写出下列化学反应方程式:
反应③___________,D与新制Cu(OH)2悬浊液反应___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R是原子序数依次增大的短周期主族元素。已知:气体YX3能使润湿的紫色石蕊试纸变蓝,Z和X在同一主族,Q原子的最外层电子数是其周期序数的2倍。回答下列问题:
(1)![]() 原子的结构示意图为 _____,YX3的化学式为 _____。
原子的结构示意图为 _____,YX3的化学式为 _____。
(2)![]() 、Q、R原子的半径从大到小的顺序是 ___________。
、Q、R原子的半径从大到小的顺序是 ___________。![]() 用原子符号表示
用原子符号表示![]() 。
。
(3)![]() 分别与X、Z形成的化合物分别是__________(填化学式),___________(填电子式)。Q与Z形成的化合物类型是_________(填离子化合物或共价化合物)。
分别与X、Z形成的化合物分别是__________(填化学式),___________(填电子式)。Q与Z形成的化合物类型是_________(填离子化合物或共价化合物)。
(4)能证明R的非金属性比Q强的实验事实是______![]() 填字母序号
填字母序号![]() 。
。
A HR的水溶液酸性比H2Q的水溶液酸性强 B R2与H2化合比Q与H2化合容易。
C R的最高价氧化物的水化物的酸性比Q的强 D HR的稳定性比H2Q强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,某有机物和过量Na反应得到V1 L氢气,取另一份等量的有机物和足量的NaHCO3反应得到V2 L二氧化碳,若2V1=V2≠0,则此有机物可能是 ( )
A. CH3CH(OH)COOHB. HOOCCH2COOH
C. HOCH2CH2OHD. HOCH2CH(OH)CH2COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃和101 kPa,乙烷、乙炔和丙烯组成的混合烃32 mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72 mL,原混合烃中乙炔的体积分数为( )
A. 15%B. 25%C. 45%D. 75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表为元素周期表的一部分.
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为__.
(2)表中元素原子半径最大的是(写元素符号)__.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__.
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1mol Y 单质比1mol S 得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1mol X 的最高价化合物,恢复至室温,放热687kJ.已知该化合物的熔沸点分别为﹣69℃和58℃,写出该反应的热化学方程式:__.
(5)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中的两种元素组成,气体的相对分子质量都小于50.为防止污染,将生成的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol/L NaOH 溶液和1mol O2,则两种气体的分子式分别为__,物质的量分别为__,生成硫酸铜物质的量为__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的少量泥沙和Ca2+、Mg2+、SO![]() 等杂质离子,先将粗盐溶于水,过滤,然后对滤液进行4项操作①过滤②加适量盐酸③加过量的NaOH和Na2CO3混合溶液④加入过量BaCl2溶液。上述4项操作的正确顺序为( )
等杂质离子,先将粗盐溶于水,过滤,然后对滤液进行4项操作①过滤②加适量盐酸③加过量的NaOH和Na2CO3混合溶液④加入过量BaCl2溶液。上述4项操作的正确顺序为( )
A.②①③④B.④②③①
C.④③①②D.②③④①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
![]() A. 向含有CaCO3沉淀的水中通入CO2 至沉淀恰好溶解,再向溶液中加入NaHCO3 饱
A. 向含有CaCO3沉淀的水中通入CO2 至沉淀恰好溶解,再向溶液中加入NaHCO3 饱
和溶液,又有CaCO3沉淀生成
B. 向Na2 CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2 CO3的物质的量之比为1:2.
C. 等质量的NaHCO3和Na2 CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D. 向Na2 CO3饱和溶液中通入CO2,有NaHCO3结晶析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态的三氧化二硼和液态水,放出649.5 kJ热量,其热化学方程式为____。
(2)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式为2NO+2CO![]() 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 |
c(NO)/ mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 |
c(CO)/mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 |
时间/s | 3 | 4 | 5 |
c(NO)/ mol·L-1 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO)/ mol·L-1 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题:
①前2s内的平均反应速率υ(N2)=____;
②上述条件下,该反应的平衡常数为____;
③上述条件下,测得某时刻反应体系中各物质的物质的量浓度均为0.01 mol/L,则此时反应处于____状态。(填“平衡”或“向右进行”或“向左进行”)
(3)实验室常用0.10 mol/L KMnO4标准酸性溶液来测定H2C2O4样品的纯度(标准液滴待测液),其反应原理为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O。
①KMnO4标准液应装在____(填“酸式”或“碱式”)滴定管;
② 清水洗净滴定管后直接装入标准液,则测定结果会____;(填“偏大”或“偏小”或“不变”)
③ 滴定过程中发现一段时间后反应速率明显加快,除去温度的影响,你认为最有可能的原因是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com