
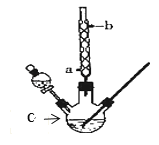
����Ŀ��ij��ѧ����С���������ͼ��ʾ��װ����ȡ����������ͼ�мг������ͼ���װ������ȥ������֪�������ݣ�
�Ҵ� | ���� | �������� | 98%Ũ���� | |
�۵�/�� | ��117.3 | 16.6 | ��83.6 | |
�е�/�� | 78.5 | 117.9 | 77.5 | 338.0 |
��ش��������⣺
(1)����C������Ϊ______�����������ܵ�������_____��
(2)��C�м��뷴Ӧ�����ַ�Ӧ��C�еĻ���ﵹ��װ�б���̼������Һ���ձ��г����ϴ�ӡ�����̼������Һ�����ǣ�����ĸ����_____
A.�к����Ტ�ܽ��Ҵ�
B.̼������Һ�ʼ��ԣ�����������������ˮ��
C.�����������������ɣ���������
D.���������ڱ���̼������Һ�е��ܽ�ȱ���ˮ�и�С�������ڷֲ�����
(3)�������ϴ�ӡ����÷�Һ��Ϊ�˽�һ���ᴿ�����������ɲ�������ķ���������ʱ�����¶���__���ң��¶ȼƵ�ˮ����Ӧλ��____��
(4)��ʵ��������������Ϊ2.4g���Ҵ�����Ϊ2.1g���õ������IJ�Ʒ����Ϊ2.64g�������������IJ�����______��
(5)��������������������Һ������Ӧ�Ļ�ѧ����ʽΪ____________��
���𰸡�������ƿ �������� AD 77.5�� ��֧�ܿ�ƽ�� 75% CH3COOC2H5+NaOH![]() CH3COONa+CH3CH2OH
CH3COONa+CH3CH2OH
��������
(1)����C������Ϊ������ƿ�����������ܵ��������������������ԭ�������ʣ�
(2)����������ԣ��ܺͱ���̼������Һ��Ӧ���ѱ����գ����������ڱ���̼������Һ�е��ܽ�Ƚ�С��
(3)���ݱ������ݿ�֪��������������ķе�Ϊ77.5�棬�¶ȼƵ�ˮ����Ӧλ��֧�ܿ���ƽλ�ã���ʱ������¶�Ϊ����¶ȣ�
(4)������Ҵ��ķ�ӦΪCH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O��2.4g�����2.1g�Ҵ����ʱ��֪�Ҵ�����������2.4g��������������������۲��������ò���=
CH3COOCH2CH3+H2O��2.4g�����2.1g�Ҵ����ʱ��֪�Ҵ�����������2.4g��������������������۲��������ò���=![]() ��100%���㣻
��100%���㣻
(5)��������������������Һ������ȫˮ�ⷴӦ�����ɴ����ƺ��Ҵ����ݴ�д����ѧ����ʽ��
(1)����C������Ϊ������ƿ�����������ܵ��������������������ԭ�������ʣ�
(2)����������ԣ��ܺͱ���̼������Һ��Ӧ���ѱ����գ����������ڱ���̼������Һ�е��ܽ�Ƚ�С�����ڷ��룬�ʺ���ѡ����AD��
(3)���ݱ������ݿ�֪��������������ķе�Ϊ77.5�棬�����ռ���ƷӦ�����¶���77.5�����ң������¶ȼƵ�ˮ����Ӧλ��֧�ܿ���ƽλ�ã�������¶Ȳ�������¶ȣ�
(4)������Ҵ��ķ�ӦΪCH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O����Ϊ60��46��2.4��2.1������2.4g�����2.1g�Ҵ����ʱ���Ҵ�������2.4g���������������������۲���=
CH3COOCH2CH3+H2O����Ϊ60��46��2.4��2.1������2.4g�����2.1g�Ҵ����ʱ���Ҵ�������2.4g���������������������۲���=![]() ��88g=3.52g�����������IJ���=
��88g=3.52g�����������IJ���=![]() ��100%=75%��
��100%=75%��
(5)��������������������Һ������ȫˮ�ⷴӦ�����ɴ����ƺ��Ҵ�����ѧ����ʽΪCH3COOC2H5+NaOH=CH3COONa+CH3CH2OH��


 ���100��1�ž�ϵ�д�
���100��1�ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��д��ȷ���ǣ� ��
A.����ͭ��ϡ���ᷴӦ��CuO+4H++SO![]() =Cu2++SO2��+2H2O
=Cu2++SO2��+2H2O
B.������̼ͨ����������ʯ��ˮ�У�Ca2++2OH-+CO2=CaCO3��+H2O
C.�������ᷴӦ��2Fe+6H+=2Fe3++3H2��
D.����������Һ�����ᷴӦ��OH-+H+=H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ⱥ��ݵ��ܱ������зֱ���������������淴Ӧ��
�ף�C(s)��H2O(g) ![]() CO(g)��H2(g)��
CO(g)��H2(g)��
�ң�CO(g)��H2O(g) ![]() CO2(g)��H2(g)
CO2(g)��H2(g)
��������״̬��
�ٻ������ƽ����Է����������ٸı�
������������ʵ������ٸı�
�۸��������Ũ�����
�ܷ�Ӧ��ϵ���¶ȱ��ֲ���
�ݶ��������������Ƕ�����������ʵ�2��
��������ܶȲ���
�����ܱ����ס��������з�Ӧ���ﵽƽ��״̬����
A. �٢�B. �ܢ�C. �ۢ�D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ч���ƴ�����������Ũ�ȣ��ƶ���ɫ��̼��չ��������ɳ�����չ����Ҫս��֮һ����˲���������CO2ʼ���ǿ�ѧ�о����ȵ㡣
��1���µ��о����������Խ�CO2ת��Ϊ̿�ڻ������ã���Ӧԭ����ͼ��ʾ��
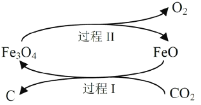
��̼��Ԫ�����ڱ��е�λ����_______________��
������������FeO��������__________________��
��д��CO2ת��Ϊ̿�ڵ��ܷ�Ӧ��ѧ����ʽ__________________��
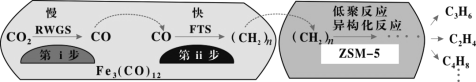
��2���ҹ���ѧ����Fe3(CO)12/ZSM-5��CO2����ϳɵ�̼ϩ����Ӧ�����ò��ﺬCH4��C3H6��C4H8�ȸ������Ӧ������ͼ��
����������Na��K��Cu����������Ҳ������ã��ɸı䷴Ӧ��ѡ���ԣ�������������ͬʱ�����Ӳ�ͬ������������ͬʱ�����CO2ת���ʺ���������ʵ����������±���
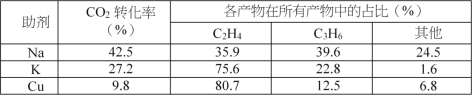
������ߵ�λʱ������ϩ�IJ�������Fe3(CO)12/ZSM-5������____________����Ч����ã�
��������������ߵ�λʱ������ϩ�����ĸ���ԭ����____________��
��3����ⷨת��CO2��ʵ��CO2��Դ�����á����CO2��HCOOH��ԭ������ͼ��ʾ��
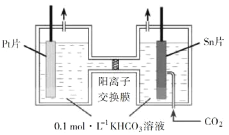
��д������CO2��ԭΪHCOO�ĵ缫��Ӧʽ��________________________��
�����һ��ʱ�����������KHCO3��ҺŨ�Ƚ��ͣ���ԭ����_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ���һ���֣������Ԫ�آ٣����ڱ��е�λ�ã�����ѧ�����ش��������⣺
�� ���� | IA | 0 | ||||||
1 | �� | ��A | ��A | ��A | ��A | ��A | ��A | |
2 | �� | �� | �� | �� | ||||
3 | �� | �� | �� | �� | ||||
(1)ԭ�Ӱ뾶��С��Ԫ����____����Ԫ�����ƣ���д�����ԭ�ӽṹʾ��ͼ______��
(2)����������Ӧ��ˮ�����У�������ǿ����___���û�ѧʽ�ش���ͬ����������ǿ����___��
(3)������γɵĻ������У���ѧ������Ϊ_____��
(4)������γɵĻ�����ĵ���ʽΪ___��������γɵ�ԭ�Ӹ�����Ϊ1:2�Ļ�����ĽṹʽΪ____��
(5)�ۡ��ܡ���ԭ�Ӱ뾶�ɴ�С��˳��Ϊ_____����Ԫ�ط��Żش𣩡�
(6)Ϊ̽��Ԫ�آں͢�ķǽ�����ǿ����ijͬѧ�������ͼ��ʾ��װ�ý���ʵ�飨�г���������ȥ��װ�����������ã�����ش�
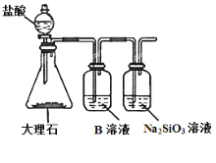
a.��ҺB��������_______
b.������____������֤������_______���û�ѧʽ�ش𣩣���ǽ�����_______����Ԫ�ط��Żش𣩡�
c.����ʵ���У���˵���ں͢�ǽ�����ǿ���Ļ�ѧ����ʽ��_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2016��IUPAC����117��Ԫ��ΪTs����������![]() ����ti��n����Ts��ԭ�Ӻ���������������7������˵������ȷ����
����ti��n����Ts��ԭ�Ӻ���������������7������˵������ȷ����
A.Ts�ǵ������ڵڢ�A��Ԫ��
B.Ts��ͬλ��ԭ�Ӿ�����ͬ�ĵ�����
C.Ts��ͬ��Ԫ���зǽ���������
D.������Ϊ176��Ts���ط�����![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ҩ�ﰢ������F��Ҫ���ڷ��ι�������֢�ȡ���ϳ�·�����£�
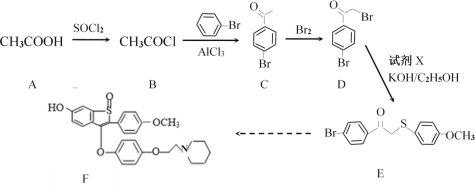
�밴Ҫ��ش��������⣺
��1��A����ƽ���ԭ����Ŀ��______��C���������������ƣ�_______��C��D�ķ�Ӧ����______________��
��2����֪±ԭ��ֱ���뱽������ʱ̼±���dz��ι̣����Ѷϼ���д��D��NaOHˮ��Һ���������·�Ӧ�Ļ�ѧ����ʽ��________________________________________��
��3���Լ�X�ķ���ʽΪC7H8OS��д��X�Ľṹ��ʽ��___________________��
��4��C��һ��ͬ���칹��Mͬʱ�����������������п��ܵĽṹ�У�����˳���칹����_________�֡�
a.������������ȡ����
b.����FeCl3��Һ������ɫ��Ӧ
c.��ʹ������Ȼ�̼��Һ��ɫ
д��������4�ֲ�ͬ��ѧ������ԭ�ӵĽṹ��ʽ��_______________________��
��5����д����1-�������ȱ�Ϊԭ�Ͼ��IJ��Ʊ� ![]() �ĺϳ�·�ߣ������Լ���ѡ���ϳ�·��ʾ������ɣ��л����д�ṹ��ʽ����________��
�ĺϳ�·�ߣ������Լ���ѡ���ϳ�·��ʾ������ɣ��л����д�ṹ��ʽ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�������о���������CH4��CO2��ת����������
��1��CH4��CO2����������Ԫ�ص縺�Դ�С�����˳��Ϊ______��
��2�����й���CH4��CO2��˵����ȷ����______������ţ���
a����̬CO2���ڷ��Ӿ���
b�� CH4�����к��м��Թ��ۼ����Ǽ��Է���
c����Ϊ̼�������С��̼����������CH4�۵����CO2
d�� CH4��CO2������̼ԭ�ӵ��ӻ����ͷֱ���sp3��sp
��3����Ni�����������£�CH4��CO2��Ӧ�ɻ�û���ԭ��CO��H2��
�ٻ�̬Niԭ�ӵĵ����Ų�ʽΪ____________��Ni��Ԫ��λ��Ԫ�����ڱ��ĵ�___����
��Ni����CO�γ����������ε������Ni��CO��4��1mol Ni��CO��4�к���_____mol������
��4��һ�������£�CH4��CO2������H2O�γ���״�ṹ����ͼ��ʾ����ˮ���ᄃ�壬����ز������±���CH4��H2O�γɵ�ˮ�����׳�����ȼ������
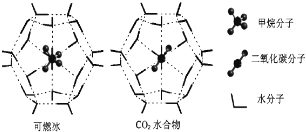
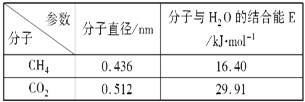
������ȼ�����з��Ӽ���ڵ�2����������______��
��Ϊ�������������ȼ�������п�ѧ�������CO2�û�CH4�����룮��֪ͼ����״�ṹ�Ŀ�ǻֱ��Ϊ0.586nm����������ͼ���������ʽṹ�����ʵĽǶȷ������������������___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���X(C4H6O5)�㷺����������ˮ���ڣ�����ƻ�������ѡ����ϡ�ɽ���Ϊ�࣬�û���������������ʣ�
��1��1molX�������Ľ����Ʒ�Ӧ����1.5 mol����
��2��X�봼��������ŨH2SO4�ͼ��ȵ������¾���������ζ�IJ���
��3��X��һ���̶��µķ�������ˮ����(���ǻ�״������)�ɺ���ˮ�����ӳɷ�Ӧ
����������Ϣ����X�Ľṹ�ж���ȷ���� ( )
A��X�п϶���̼̼˫��
B��X�п����������ǻ���һ��-COOR������
C��X�п����������Ȼ�
D��X�п����������Ȼ���һ���ǻ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com