

| ||
| △ |
| ||
| ||
| ||
| ||
| ||
| △ |
| ||
| △ |


科目:高中化学 来源: 题型:
| A、化学反应过程中一定伴有能量释放出来 |
| B、化学反应的基本特征是有新物质生成 |
| C、化学反应的过程实际上是一个旧键断裂,新键生成的过程 |
| D、在一确定的化学反应关系中,反应物的总能量与生成物的总能量一定不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相对原子质量和核外电子数 |
| B、电子层数和最外层电子数 |
| C、相对原子质量的最外层电子数 |
| D、电子层数的次外层电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

| 空瓷舟质量m0/g | 瓷舟与钙的质量m1/g | 瓷舟与产物的质量m2/g |
| 14.80 | 15.08 | 15.25 |

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
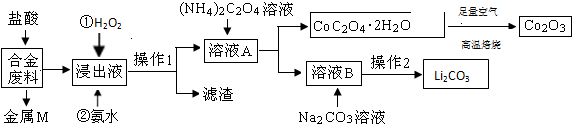
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol?L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com