
【题目】工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
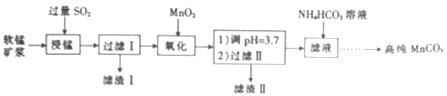
(1)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为____和_____(填离子符号)。
(2)写出氧化过程中MnO2与SO2反应的化学方程式:____________。
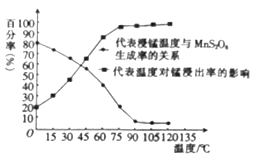
(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是___________。
(4)向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度控制在30-35℃,温度不宜太高的原因是___。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:_______。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是_________________。
【答案】Mn2+Fe2+MnO2+SO2=MnSO490℃防止NH4HCO3受热分解,提高原料利用率Mn2++2HCO3-=MnCO3↓+CO2↑+H2O取1-2mL最后一次的洗涤于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明乙洗涤干净
【解析】试题分析:分析信息和工艺流程知向软锰矿浆通入过量二氧化硫,浸锰,酸性条件下,利用二氧化硫的还原性将二氧化锰、氧化铁分别还原为硫酸锰和硫酸亚铁,过滤,滤渣Ⅰ为二氧化硅,向滤液中加入过量二氧化锰,过量的二氧化硫和二氧化锰反应生成硫酸锰,将Fe2+氧化为Fe3+,调pH=3.7,将Fe3+转化为氢氧化铁沉淀,过滤,滤渣Ⅱ为氢氧化铁和二氧化锰,滤液为硫酸锰溶液,向滤液种加入适量NH4HCO3溶液,发生反应:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,过滤、洗涤、干燥,得碳酸锰(MnCO3)。据此作答。
(1)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为Mn2+和Fe2+。
(2)氧化过程中,MnO2与SO2反应生成硫酸锰,化学方程式为MnO2+SO2=MnSO4。
(3)分析图像知温度在90℃以后MnS2O6的生成率较低,锰的浸出率较高,且温度较低节约能源,故“浸锰”的适宜温度是90℃。
(4)铵盐受热易分解,向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度控制在30-35℃的原因是防止NH4HCO3受热分解,提高原料利用率。
(5)硫酸锰与NH4HCO3溶液反应生成MnCO3沉淀、水和二氧化碳,反应的离子方程式Mn2++2HCO3-=MnCO3↓+CO2↑+H2O。
(6)生成的MnCO3沉淀表面有硫酸根等杂质离子,检验沉淀是否洗涤干净可检验最后一次洗涤液中是否含有硫酸根,检验洗涤是否完全的方法是取1-2mL最后一次的洗涤于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明乙洗涤干净。


科目:高中化学 来源: 题型:
【题目】某白色粉未由两种物质组成,取少量样品加入足量水中,固体部分溶解,再向其中加入足量NaOH溶液,振荡,固体全部溶解;另取少量白色粉末加入足量硫酸,有气泡产生且有淡黄色不溶物生成。则该白色粉末可能为
A. N a2CO3、CaO B. Na2S2O3、Al2O3 C. Na2O2、Al(OH)3 D. NaI、AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,我国储氢碳管研究获得重大进展,电弧法合成碳纳米管,常伴有大量物质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
3C + 2K2Cr2O7 + 8H2SO4(稀)= 3CO2↑ + 2K2SO4 + 2Cr2(SO4)3 + 8 H2O
请回答下列问题。
(1)H2O的摩尔质量为___________,0.18g H2O的物质的量为_______________mol
(2)配制0.1mol/L H2SO4溶液500mL,则需要H2SO4的质量为_____________g
(3)在上述的反应中,若生成22g CO2
ⅰ.标准状况下,CO2的体积为_________L
ⅱ.转移电子的数目为________________
(4)标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,则该混合气体的平均相对分子质量是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.分别测等浓度的醋酸和氨水pH ,发现二者的pH 之和为14,说明常温下醋酸和氨水的电离平衡常数相等
B.将CH3COONa溶液从25℃ 升温至 40℃ ,溶液中![]() 增大
增大
C.向硝酸中加入氨水至中性,溶液中![]() <1
<1
D.向AgCl、AgBr 的饱和溶液中加入少量 AgNO3,溶液中![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有下列各组离子的溶液中,通入(或加入)过量的某种物质后仍能大量共存的是
A. H+、Ba2+、Fe3+、NO3-,通入SO2气体
B. AlO2-、Na+、Br-、SO42-,通入CO2气体
C. Ca2+、Cl-、K+、H+,通入CO2气体
D. HCO3-、Na+、I-、HS-,加入AlCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案能达到实验目的的是
A. 证明浓度的的改变可导致平衡移动:将少量KCl晶体加入FeCl3+3KSCN![]() Fe(SCN)3+3KCl的平衡体系中
Fe(SCN)3+3KCl的平衡体系中
B. 除去MgCl2溶液中少量的FeCl3:向含有少量FeCl3的MgCl2溶液中加入足量的Mg(OH)2粉末,搅拌一段时间后过滤
C. 检验某溶液中是否含有乙醛:向盛有2mL 10%CuSO4溶液的试管中滴加0.5mL10%NaOH溶液,混合均匀,滴入待检液,加热
D. 证明Fe3+的氧化性大于I2:将KI溶液和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置,下层溶液显紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或很少污染,且有些可以再生。下列属于新能源的是:①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥地热能 ⑦风能 ⑧氢能( )
A.①②③④ B.⑤⑥⑦⑧ C.③④⑤⑥ D.除①②外
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )

A.X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C.YX2晶体熔化、液态WX3气化均需克服分子间作用力
D.根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(双选)(2015广东)甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )

A.丙与戊的原子序数相差28
B.气态氢化物的稳定性:庚<己<戊
C.常温下,甲和乙的单质均能与水剧烈反应
D.丁的最高价氧化物可用于制造光导纤维
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com