
【题目】根据下列化合物:①NaCl、②NaOH、③HCl、④NH4Cl、⑤CH3COONa、⑥CH3COOH、⑦NH3·H2O、⑧H2O。回答下列问题。
(1)NH4Cl溶液显________性,用离子方程式表示原因______________,其溶液中离子浓度大小顺序为________________
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=__________mol/L,在pH=3的CH3COOH溶液中,水电离出来的c(H+)=__________mol/L。
(3)已知纯水中存在如下平衡:H2O+H2O![]() H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是______(填字母序号)。
H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是______(填字母序号)。
A.向水中加入NaHSO4固体 B.向水中加Na2CO3固体
C.加热至100℃ D.向水中加入(NH4)2SO4固体
(4)若将等pH、等体积的②NaOH和⑦NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m______n(填“<”、“>”或“=”)。
(5)除④⑦⑧外,若其余5种溶液的物质的量浓度相同,则这5种溶液按pH由大到小的顺序为:_________________(填序号)
【答案】(1)酸(1分)NH4++H2O![]() NH3·H2O+H+(2分)
NH3·H2O+H+(2分)
c(Cl-)>c(NH4+)>c(H+)>c(OH-)(1分)
(2)10-3 10-11(3)D(4)m<n
(5)②>⑤>①>⑥>③(各1分)
【解析】
试题分析:
(1)氯化铵为强酸弱碱盐,水解呈酸性;铵根离子水解的离子方程式为NH4++H2O![]() H++NH3·H2O,铵根离子水解,则c(Cl-)>c(NH4+),所以溶液中离子浓度关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
H++NH3·H2O,铵根离子水解,则c(Cl-)>c(NH4+),所以溶液中离子浓度关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(2)CH3COONa为强碱弱酸盐,pH=11的CH3COONa溶液中,c(OH-)=10-3mol/L,c(H+)=10-11mol/L,CH3COONa 中氢离子和氢氧根离子都是水电离的,则水电离出来的c(OH-)为10-3mol/L;在pH=3的CH3COOH溶液中,c(OH-)=10-11mol/L,酸中的氢氧根离子由水电离,则水电离出来的c(OH-)=c(H+)为10-11mol/L;
(3)A.向水中加入NaHSO4固体,电离出的氢离子抑制水的电离,故A错误;B.向水中加Na2CO3固体,水解呈碱性,故B错误;C.加热至100℃,促进水的电离,溶液呈中性,故C错误;D.向水中加入(NH4)2SO4固体,水解呈酸性,故D正确;故答案为D;
(4)氨水为弱电解质,不能完全电离,如稀释相等体积,氨水溶液pH大,如稀释后溶液pH相同,则氨水应加入较多水;
(5)在①NaCl、②NaOH、③HCl、⑤CH3COONa、⑥CH3COOH中,显示碱性的为:②NaOH、⑤CH3COONa,氢氧化钠为强碱,CH3COONa因为水解呈碱性,但水解很微弱,所以pH②>⑤;显示中性的为①NaCl,pH=7;显示酸性的为:③HCl、⑥CH3COOH,浓度相同时,盐酸为强酸,氢离子浓度最大,醋酸为一元弱酸,氢离子浓度小于盐酸,所以pH⑥>③,故物质的量浓度相同时,按pH由大到小的顺序为:②>⑤>①>⑥>③


科目:高中化学 来源: 题型:
【题目】 设NA为阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,5.6L CCl4含有的分子数为0.25NA
B.标准状况下,14 g氮气含有的核外电子数为5NA
C.标准状况下,22.4 L任意比的氢气和氯气的混合气体中含有的分子总数均为NA
D.在标准状况下,18gH2O所含有的电子数不是10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2 mol A与2 mol B混合于2 L的密闭容器中,发生反应:2A(g)+3B(g)![]() 2C(g)+zD(g),若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
2C(g)+zD(g),若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
A.v(C)=0.2 mol·L-1·s-1
B.z=3
C.B的转化率为25%
D.C平衡时的浓度为0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的可逆反应A(g)+3B(g)![]() 2C(g),下列说法中,能说明这一反应已经达到化学平衡状态的是( )
2C(g),下列说法中,能说明这一反应已经达到化学平衡状态的是( )
A.生成C的速率与C分解的速率相等
B.A、B、C的浓度相等
C.单位时间生成n mol A,同时生成3n mol B
D.A、B、C的分子数之比为1∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A与D、C与E分别同主族,D、E、F同周期,B原子的最外层电子数是内层电子数的2.5倍,A与C形成的常见化合物在常温下为液态。
(1)元素A在周期表中的位置是________;D、E、F形成的简单离子中半径最大的是_______(填离子符号)。
(2)常温下,F的单质能与由A、C、D三种元素组成的一种常见化合物发生反应,该反应的化学方程式为________。
(3) E与F的最简单气态氢化物中稳定性较强的是________(填化学式)。
(4)元素B和元素F能形成一种化合物BF3,其中F显+1价。BF3能发生水解反应生成一种弱碱和一种弱酸,写出该反应的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵可用于火箭推进剂,实验室可由NaClO3等原料制取(部分物质溶解度如图),其实验流程如下:
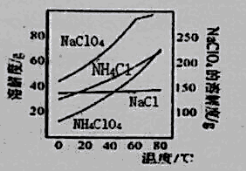
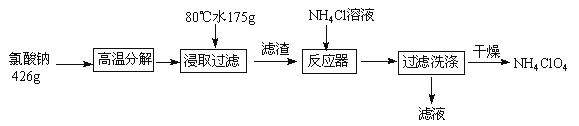
(1)氯酸钠受热分解生成高氯酸钠和氯化钠的化学方程式为_______________。
(2)80℃时浸取液冷却至0℃过滤,滤渣的主要成分为_________________(写化学式)。
(3)反应器中加入氯化铵饱和溶液发生反应的离子方程式为 _____________________。
(4)已知:2NH4ClO4![]() N2↑+2O2↑+Cl2↑+4H2O,现可提供下列试剂:
N2↑+2O2↑+Cl2↑+4H2O,现可提供下列试剂:
a.饱和食盐水 b.浓H2SO4 c.NaOH溶液 d.Mg e.Cu f.Fe
利用下图装置对高氯酸铵热分解产生的三种气体进行分别吸收或收集。
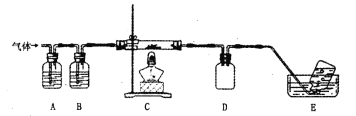
①E中收集到的气体可能是__________________(填化学式)
②A、B、C中盛放的药品依次可以是__________(选填:“I”“II”“III”)。
I.abd II.cbe III.bcf
(5)过滤用到的主要玻璃仪器是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的量和阿伏加德罗常数的说法,不正确的是
A.0.6gCaCO3和Mg3N2的混合物中所含质子数为0.3NA
B.常温常压下,22.4LCH4中所含原子数小于5NA
C.含有0.2molH2SO4的浓硫酸与足量铜加热条件下反应,转移的电子数一定小于0.2NA
D.标准状况下,22.4L苯所含碳原子的物质的量是6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应的ΔH=-122 kJ/mol、ΔS= + 231 J/(mol·K),下列说法正确的是( )
A.此反应在任何温度下都能自发进行 B.此反应仅在低温下自发进行
C.此反应仅在高温下自发进行 D.此反应在任何温度下都不能自发进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com