
【题目】下列有关物质的量和阿伏加德罗常数的说法,不正确的是
A.0.6gCaCO3和Mg3N2的混合物中所含质子数为0.3NA
B.常温常压下,22.4LCH4中所含原子数小于5NA
C.含有0.2molH2SO4的浓硫酸与足量铜加热条件下反应,转移的电子数一定小于0.2NA
D.标准状况下,22.4L苯所含碳原子的物质的量是6mol
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:
【题目】用12moL·L-1浓盐酸配制250mi-0.1 mol.L-1的盐酸溶液时,下列实验操作会使配得的溶液浓度偏大的是( )
A. 用量筒量取浓盐酸时俯视读数
B. 最后定容时仰视读数
C. 将浓盐酸倒入烧杯后,用水洗涤量筒2—3次,并将洗涤液一并倒入容量瓶中
D. 定容后把容量瓶倒置摇匀,发现液面低于刻度,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列化合物:①NaCl、②NaOH、③HCl、④NH4Cl、⑤CH3COONa、⑥CH3COOH、⑦NH3·H2O、⑧H2O。回答下列问题。
(1)NH4Cl溶液显________性,用离子方程式表示原因______________,其溶液中离子浓度大小顺序为________________
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=__________mol/L,在pH=3的CH3COOH溶液中,水电离出来的c(H+)=__________mol/L。
(3)已知纯水中存在如下平衡:H2O+H2O![]() H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是______(填字母序号)。
H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是______(填字母序号)。
A.向水中加入NaHSO4固体 B.向水中加Na2CO3固体
C.加热至100℃ D.向水中加入(NH4)2SO4固体
(4)若将等pH、等体积的②NaOH和⑦NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m______n(填“<”、“>”或“=”)。
(5)除④⑦⑧外,若其余5种溶液的物质的量浓度相同,则这5种溶液按pH由大到小的顺序为:_________________(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用氢键知识解释的是 ( )
A. 水分子高温下也很稳定
B. 水和乙醇可以完全互溶
C. 冰的密度比液态水的密度小
D. 液态氟化氢的化学式有时可以写成(HF)n的形式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图2所示,β-紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1。下列说法正确的是
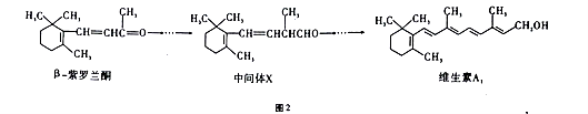
A.β-紫罗兰酮的分子式为C13H22O
B.1mol中间体X 最多能与2molBr2发生加成反应
C.维生素A1难溶于CCl4溶液
D.β-紫罗兰酮与中间体X互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的离子积常数随温度升高而升高。关于一定量的水,下列叙述正确的是
A. 温度升高,水中分子总数减少 B. 水中c(OH-)随温度升高而降低
C. 水的pH随温度升高而升高 D. 水的电离过程是放热过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH-=FeO42-+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42-,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只有在强碱性条件下稳定,易被H2还原。
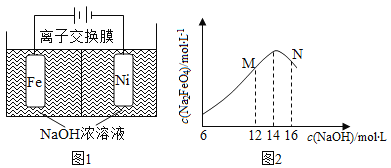
①电解一段时间后,c(OH-)降低的区域在__________(城 “阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是________。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、M、N四种金属,有如下相关信息,据此分析,这四种金属的活动性由强到弱的顺序是( )
① X + Y(NO3)2 = X(NO3)2 + Y
② X 与H2SO4(稀)不反应
③ M + H2SO4(稀) =MSO4 + H2↑
④ N + MSO4 = NSO4 + M
A. N>M>X>Y B. Y>X>M>N C. X>Y>M>N D.N>M>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2+Fe +2H2O=Fe(OH)2+Ni(OH)2
(1)金属镍在元素周期表中的位置是______________。
(2)此蓄电池放电时,该电池发生氧化反应的物质是________(城序号)。
A. NiO2 B.Fe C. Fe(OH)2 D.Ni(OH)2
(3)此蓄留电池充电时,阳极的电极反应式是____________。
(4)用该蓄电池电解含有0.2molNaCl的混合溶液100mL,假如电路中转移了0.1mo电子,且电解池的电极均为惰性电极。阳极产生的气体在标准状况下的体积是________;将电解后的溶液加水稀释至1L,此时溶液的pH=________________。
(5)该电池电极材料对环境有危害。在对电池进行回收处理过程中遇到以下问题:己知:常温下Ksp[Fe(OH)3]=1.0×10-34,Ksp[Ni(OH)2]=1.0×10-15。某溶液中含有0.1mol/L的Ni2+和0.1mol/LFe3+,当逐滴加入NaOH溶液(忽略溶液体积改变),
①先沉淀的离子是________。
②要想使Fe3+沉淀完全,Ni2+不沉淀,溶液的pH需控制的范围是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com