
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 五种物质中含有同一种元素,其相互转化的关系如图所示。已知
五种物质中含有同一种元素,其相互转化的关系如图所示。已知![]() 是黄色固体,回答下列问题。
是黄色固体,回答下列问题。
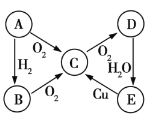
(1)写出![]() 、
、![]() 的化学式:
的化学式:![]() ______、
______、![]() ______。
______。
(2)写出![]() 的化学方程式:____________。
的化学方程式:____________。
(3)将足量的物质![]() 通入
通入![]() 溶液中,下列说法正确的是______(填序号)。
溶液中,下列说法正确的是______(填序号)。
a.溶液没有明显变化
b.溶液中出现白色沉淀
c.若继续通入![]() ,则溶液中出现白色沉淀
,则溶液中出现白色沉淀
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是 ( )
A. 标准状况下,22.4L水中所含的分子数约为6.02×1023
B. 标准状况下,aL的氧气和氮气的混合物含有的分子数约为![]() ×6.02×1023
×6.02×1023
C. 22 g二氧化碳与标准状况下11.2 L 氯化氢气体含有的分子数不同
D. 2.24L CO2中含有的原子数为0.3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在习题解析中看到:“SO2通入Ba(NO3)2溶液出现白色沉淀,是因为在酸性环境中,NO3-将SO32-氧化成SO42-而产生沉淀”。有同学对这个解析提出了质疑,“因没有隔绝空气,也许只是![]() 氧化了SO32-,与NO3-无关”。于是做了“SO2通入Ba(NO3)2溶液”的探究实验,用pH传感器检测反应的进行,实验装置如图。回答下列问题:
氧化了SO32-,与NO3-无关”。于是做了“SO2通入Ba(NO3)2溶液”的探究实验,用pH传感器检测反应的进行,实验装置如图。回答下列问题:

(1)仪器a的名称为__。
(2)实验小组发现装置C存在不足,不足之处是__。
(3)用0.1mol/LBaCl2溶液、0.1mol/LBa(NO3)2溶液、食用油,配制4种溶液(见下表)分别在装置C中进行探究实验。
编号 | ① | ② | ③ | ④ |
试剂 | 煮沸过的BaCl2溶液25mL,再加入食用油25mL | 未煮沸过的BaCl2溶液25mL | 煮沸过的Ba(NO3)2溶液25mL,再加入食用油25mL | 未煮沸过的Ba(NO3)2溶液25mL |
对比①、②号试剂,探究的目的是___。
(4)进行①号、③号实验前通氮气的目的是__。
(5)实验现象:①号依然澄清,②、③、④号均出现浑浊。第②号实验时C中反应的离子方程式为__。
(6)图1-4分别为①,②,③,④号实验所测pH随时间的变化曲线。
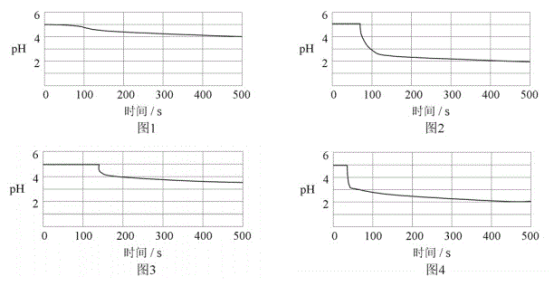
根据以上数据,可得到的结论是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼化钒(VB2)—空气电池是目前储电能力最高的电池,电池示意图如下,该电池工作时反应为:4VB2 + 11O2 = 4B2O3 + 2V2O5,下列说法正确的是
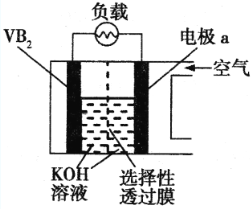
A.电极a为电池负极,发生还原反应
B.每消耗1molVB2转移6mol电子
C.电池工作时,OH向电极a移动
D.VB2极发生的电极反应为:2VB2+22OH-22e=V2O5+2B2O3+11H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ·mol-1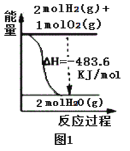
B.图2表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大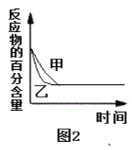
C.图3表示某吸热反应在无催化剂(a)和有催化剂(b)时反应的能量变化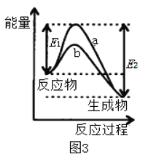
D.图4表示某可逆反应的速率随时间的变化关系,t0时刻改变的条件可能是使用了催化剂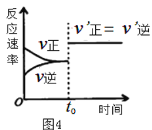
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是
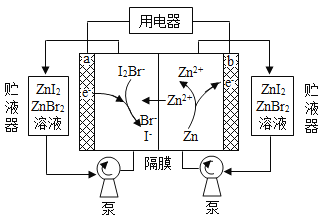
A. 放电时,a电极反应为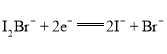
B. 放电时,溶液中离子的数目增大
C. 充电时,b电极每增重![]() ,溶液中有
,溶液中有![]() 被氧化
被氧化
D. 充电时,a电极接外电源负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M的结构简式如图,有关M的下列叙述中正确的是

A. 可与H2反应,1 molM最多消耗1 molH2
B. 可与浓溴水反应,1molM最多消耗4 molBr2
C. 可与NaOH溶液反应,1 mol M最多消耗3 molNaOH
D. 常温下,M在水中的溶解度小于苯酚在水中的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,有甲、乙两个密闭容器,甲容器的体积为1 L,乙容器的体积为2 L,分别向甲、乙两容器中加入6 mol A和3 mol B,发生反应如下:3A(g)+bB(g)![]() 3C(g)+2D(g) ΔH<0;4 min时甲容器内的反应恰好达到平衡,A的浓度为2.4 mol/L,B的浓度为1.8 mol/L;t min时乙容器内的反应达平衡,B的浓度为0.8 mol/L。根据题给信息回答下列问题:
3C(g)+2D(g) ΔH<0;4 min时甲容器内的反应恰好达到平衡,A的浓度为2.4 mol/L,B的浓度为1.8 mol/L;t min时乙容器内的反应达平衡,B的浓度为0.8 mol/L。根据题给信息回答下列问题:
(1)甲容器中反应的平均速率v(B)=____,化学方程式中计量数b=____;
(2)乙容器中反应达到平衡时所需时间t___4min(填“大于”、“小于”或“等于”),原因是_____;
(3)若要使甲、乙容器中B的平衡浓度相等,可以采取的措施是___;
A. 保持温度不变,增大甲容器的体积至2L
B. 保持容器体积不变,使甲容器升高温度
C. 保持容器压强和温度都不变,向甲中加入一定量的A气体
D. 保持容器压强和温度都不变,向甲中加入一定量的B气体
(4)写出平衡常数表达式K=____,并计算在T℃时的化学平衡常数K=____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com