
【题目】已知A、B、C、D、E是短周期中的五种非金属元素,它们的原子序数依次增大.A元素原子形成的离子就是一个质子,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍.E元素与D元素同主族;E的单质为黄色晶体,易溶入CS2
(1)请写出元素符号:B;C;
(2)画出E的阴离子结构示意图:;
(3)A单质和C单质在一定条件下反应生成化合物X,该反应的化学方程式为;
(4)将9gB单质在足量的D单质中燃烧,所得气体通入1L 1mol/L的NaOH溶液中,完全吸收后,溶液中(除Na+外)浓度最大的离子是 .
【答案】
(1)C;N
(2)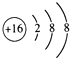
(3)N2+3H2 ![]() 2NH3
2NH3
(4)HCO ![]()
【解析】解:A、B、C、D、E是短周期中的5种非金属元素,它们的原子序数依次增大.A元素原子形成的离子就是一个质子,则A为H元素;B原子的最外层电子数是内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故B为碳元素;E的单质为黄色晶体,易溶于二硫化碳,则E为S元素;E元素与D元素同主族,则D为O元素;C、D在元素周期表中处于相邻的位置,且D的原子序数大,则C为N元素.(1)由上述分析可知,B为C元素、C为N元素,所以答案是:C;N;(2)E的阴离子为S2﹣ , 离子结构示意图: 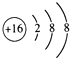 ,所以答案是:
,所以答案是: 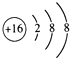 ;(3)A的单质为氢气、C的单质为氮气,二者在一定条件下反应生成化合物X为NH3 , 反应方程式为:N2+3H2
;(3)A的单质为氢气、C的单质为氮气,二者在一定条件下反应生成化合物X为NH3 , 反应方程式为:N2+3H2 ![]() 2NH3 , 所以答案是:N2+3H2
2NH3 , 所以答案是:N2+3H2 ![]() 2NH3;(4)9g碳单质的物质的量是
2NH3;(4)9g碳单质的物质的量是 ![]() =0.75mol,完全燃烧生成CO2为0.75mol,NaOH的物质的量为1L×1mol/L=1mol,二氧化碳与氢氧化钠的物质的量之比为3:4,由CO2+NaOH=NaHCO3、CO2+2NaOH=Na2CO3+H2O可知,产物是Na2CO3、NaHCO3的混合物,令碳酸钠与碳酸氢钠的物质的量分别为xmol、ymol,根据碳元素守恒由x+y=0.75,根据钠元素守恒有2x+y=1,联立方程,解得x=0.25,y=0.5,离子水解程度微弱,故溶液中(除Na+外)浓度最大的离子是 HCO3﹣ , 所以答案是:HCO3﹣ .
=0.75mol,完全燃烧生成CO2为0.75mol,NaOH的物质的量为1L×1mol/L=1mol,二氧化碳与氢氧化钠的物质的量之比为3:4,由CO2+NaOH=NaHCO3、CO2+2NaOH=Na2CO3+H2O可知,产物是Na2CO3、NaHCO3的混合物,令碳酸钠与碳酸氢钠的物质的量分别为xmol、ymol,根据碳元素守恒由x+y=0.75,根据钠元素守恒有2x+y=1,联立方程,解得x=0.25,y=0.5,离子水解程度微弱,故溶液中(除Na+外)浓度最大的离子是 HCO3﹣ , 所以答案是:HCO3﹣ .


科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的有
A. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B. 蒸馏时,应使温度计的水银球靠近蒸馏烧瓶的瓶底
C. 过滤时,玻璃棒下端在引流过程中应靠在三层滤纸处
D. 称量时,称量物放在纸上置于托盘天平左盘,砝码直接放在天平右盘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平达喜是一种常用抗酸药,其主要成分是由短周期元素组成的化合物X,式量为602.甲同学欲探究X的组成.查阅资料:
①由短周期元素组成的抗酸药的有效成分有碳酸氢钠、碳酸镁、氢氧化铝、硅酸镁铝、碱式碳酸镁铝(或结晶水合物).
②Al3+在pH=5.0时沉淀完全;Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全.
实验过程:
Ⅰ.向一定量的X粉末中加入45.0 mL的2mol/L盐酸溶液中,恰好完全反应并收集到112 mL(标准状况下)的A气体,A气体可使澄清石灰水变浑浊.
Ⅱ.用铂丝蘸取少量Ⅰ中所得的溶液,在火焰上灼烧,无黄色火焰.
Ⅲ.向Ⅰ中所得的溶液中滴加氨水,调节pH至5~6,产生白色沉淀B,过滤.
Ⅳ.向沉淀B中加过量NaOH溶液,沉淀全部溶解.
Ⅴ.向Ⅲ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C.沉淀物进行洗涤干燥后重1.74 g.
(1)A的电子式是 .
(2)由Ⅰ中可确定X中存在两种带负电荷的原子团及个数比 .
(3)由Ⅰ判断X一定不含有的元素是 .
(4)Ⅲ中生成B的离子方程式是 .
(5)Ⅳ中B溶解的化学方程式是 .
(6)沉淀C的化学式是 .
(7)若X中n(B):n(C)=1:3,则X的化学式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关物质的浓度关系正确的是( )
A.c(NH ![]() )相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl)
)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl)
B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
C.1.0 mol/L Na2CO3溶液:c(OH﹣)=c(HCO ![]() )+c(H+)+2c(H2CO3)
)+c(H+)+2c(H2CO3)
D.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH﹣)+c(HA﹣)+c(A2﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1molL﹣1 NaOH溶液滴定20mL 0.1molL﹣1CH3COOH溶液的滴定曲线如图所示.下列说法正确的是( ) 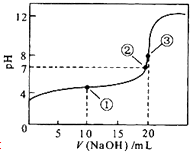
A.点①所示溶液中:c(Na+)>c(CH3COO﹣)>c(CH3COOH)>c(H+)>c(OH﹣)
B.点②所示溶液中:c(Na+)+c(H+)=c(CH3COO﹣)+c(CH3COOH)+c(OH﹣)
C.点③所示溶液中:c(CH3COO﹣)>c(Na+)>c(OH﹣)>c(H+)
D.在整个滴定过程中:溶液中 ![]() 始终不变
始终不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】垃圾是放错地方的资源,工业废料也可以再利用.某化学兴趣小组在实验室中用废弃的含铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3).实验方案如图:
(1)写出滤液A中加入足量硫酸后所发生反应的离子方程式: .
(2)已知Fe(OH)3沉淀的pH是3~4,溶液C通过调节pH可以使Fe3+沉淀完全.下列物质中可用作调整溶液C的pH的试剂是(填序号).
A.铜粉
B.氨水
C.氢氧化铜
D.碳酸铜
(3)常温,若溶液C中金属离子均为1molL﹣1 , Ksp[Fe(OH)3]=4.0×10﹣38 , Ksp[Cu(OH)2]=2.2×10﹣20 . 控制pH=4,溶液中c(Fe3+)= , 此时Cu(OH)2沉淀生成(填“有”或“无”).
(4)将20mLAl2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液80mL混合,反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,取一定质量的硫酸铜溶液,用石墨做电极进行电解,当阳极产生标况下气体1.12L时,CuSO4恰好被完全电解,得到密度为1.2gcm﹣3的溶液200mL.求:
(1)写出用石墨为电极电解CuSO4溶液的化学方程式 .
(2)电解后所得溶液的pH为 .
(3)电解前所取CuSO4溶液的质量为g.
(4)若要使电解后所得溶液恢复至电解前的原状态,需要加入何种物质(只要求写出一种),其化学式为 , 加入物质的质量为g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2 表示逆反应的活化能).下列有关叙述正确的是( ) 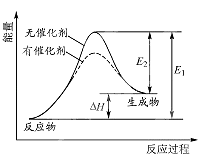
A.该反应为放热反应
B.催化剂能改变该反应的焓变
C.催化剂能降低该反应的活化能
D.逆反应的活化能大于正反应的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能大量共存的是( ) ①Na+、Fe2+、H+、NO ![]() ②K+、NH
②K+、NH ![]() 、HCO
、HCO ![]() 、OH﹣
、OH﹣
③S2﹣、SO ![]() 、Cl﹣、OH﹣④Fe2+、Fe3+、Cu2+、SO
、Cl﹣、OH﹣④Fe2+、Fe3+、Cu2+、SO ![]()
⑤K+、Na+、AlO ![]() 、HCO
、HCO ![]() ⑥Ca2+、Na+、SO
⑥Ca2+、Na+、SO ![]() 、CO
、CO ![]() .
.
A.①⑥
B.③
C.②⑤
D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com