
【题目】以重晶石(BaSO4为主,含有钙等杂质)为原料,可按如下工艺生产碳酸钡:
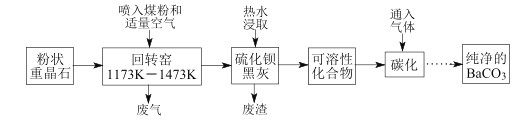
温度为1173K~1473K时回转窑中发生的主要反应:C+O2![]() CO2,C+CO2
CO2,C+CO2![]() 2CO;BaSO4+4C
2CO;BaSO4+4C![]() BaS+4CO↑,BaSO4+2C
BaS+4CO↑,BaSO4+2C![]() BaS+2CO2↑。
BaS+2CO2↑。
(1)煤粉的主要作用是______________。
(2)若回转窑中通过量空气,则BaCO3产率________(填“降低”、“升高”、“不变”)。
(3)用 90~95℃的热水浸取BaS转化为可溶性化合物时无气体生成,此过程反应的化学方程式__________________。
(4)在回转窑产生的废气,其中________可以在碳化过程得到重新利用;硫化钡黑灰热水浸取,保温后热过滤除去的残渣也可在其他工业生产中再利用,如废渣中的 CaSO4可作 ____________(写一种即可)。
(5)为了得到纯净的BaCO3,省略的操作是_____________________。
(6)已知反应BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq),某同学利用该反应在实验室模拟BaSO4转化为BaCO3的过程:若每次加入1 L 2 mol/L的Na2CO3溶液,至少需要____次,可以将0.3 mol BaSO4完全转化为BaCO3。[Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=5×10-9]
BaCO3(s)+SO42-(aq),某同学利用该反应在实验室模拟BaSO4转化为BaCO3的过程:若每次加入1 L 2 mol/L的Na2CO3溶液,至少需要____次,可以将0.3 mol BaSO4完全转化为BaCO3。[Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=5×10-9]
【答案】燃烧供热和作还原剂 降低 2BaS+2H2O![]() Ba(HS)2+Ba(OH)2 CO2 建筑材料、制石膏 过滤、洗涤、干燥 8
Ba(HS)2+Ba(OH)2 CO2 建筑材料、制石膏 过滤、洗涤、干燥 8
【解析】
在回转窑中C与O2反应产生CO2、CO,同时放出大量的热,C与BaSO4反应产生BaS,然后将BaS、C的混合物用热水浸取,发生反应2BaS+2H2O![]() Ba(HS)2+Ba(OH)2,过滤除去C单质,向可溶性混合物的水溶液中通入适量CO2气体,反应产生BaCO3沉淀,再经过滤、洗涤、干燥可得到纯净的BaCO3。
Ba(HS)2+Ba(OH)2,过滤除去C单质,向可溶性混合物的水溶液中通入适量CO2气体,反应产生BaCO3沉淀,再经过滤、洗涤、干燥可得到纯净的BaCO3。
(1)在回转窑中加入煤粉和重晶石,在温度为1173K~1473K时回转窑中发生的主要反应:C+O2![]() CO2,C+CO2
CO2,C+CO2![]() 2CO;BaSO4+4C
2CO;BaSO4+4C![]() BaS+4CO↑,BaSO4+2C
BaS+4CO↑,BaSO4+2C![]() BaS+2CO2↑;煤粉燃烧放出大量的热,且C与BaSO4反应生成BaS的反应中C为还原剂,可见煤粉的主要作用是燃烧供热和作还原剂;
BaS+2CO2↑;煤粉燃烧放出大量的热,且C与BaSO4反应生成BaS的反应中C为还原剂,可见煤粉的主要作用是燃烧供热和作还原剂;
(2)若回转窑中通过量空气,S元素会部分被氧化,导致BaS的量减少,则由BaS制取得到的BaCO3就会减少,因此最终使BaCO3产率降低;
(3)用 90~95℃的热水浸取BaS转化为可溶性化合物时,此时无气体生成,此过程反应的化学方程式为:2BaS+2H2O![]() Ba(HS)2+Ba(OH)2;
Ba(HS)2+Ba(OH)2;
(4)在回转窑产生的废气中含有CO、CO2,其中CO2在碳化过程与Ba(HS)2、Ba(OH)2发生反应:Ba2++2HS-+CO2+H2O=BaCO3↓+2H2S↑、CO2+Ba(OH)2=BaCO3↓+H2O,得到重新利用,可用于制取BaCO3;硫化钡黑灰热水浸取,保温后热过滤除去的残渣中含有未反应的C单质及CaSO4,也可在其他工业生产中再利用,如废渣中的 CaSO4可作建筑材料,也可以用于制取石膏;
(5)从反应后的溶液中过滤可得到BaCO3,为了得到纯净的BaCO3,要除去固体表面的杂质离子,所以省略的操作是过滤、洗涤、干燥;
(6)已知反应BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq),假设每次能处理BaSO4的物质的量为x,根据方程式可知反应产生SO42-物质的量为x,反应消耗CO32-后剩余离子物质的量为(2-x)mol,K=
BaCO3(s)+SO42-(aq),假设每次能处理BaSO4的物质的量为x,根据方程式可知反应产生SO42-物质的量为x,反应消耗CO32-后剩余离子物质的量为(2-x)mol,K=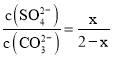 =
=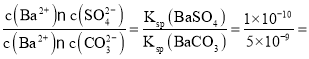 0.02,解得x=0.039 mol,所以需要处理的次数为:
0.02,解得x=0.039 mol,所以需要处理的次数为:![]() =7.69,故至少要处理8次。
=7.69,故至少要处理8次。


科目:高中化学 来源: 题型:
【题目】V L浓度为0.5 mol·L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是( )。
A. 通入标准状况下的HCl气体11.2V L
B. 加入10 mol·L-1的盐酸0.1V L,再稀释至1.5V L
C. 将溶液加热浓缩到0.5V L
D. 加入V L 1.5 mol·L-1的盐酸混合均匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家凯库勒研究提出的苯分子结构模型如图所示:
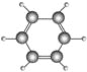
(1)请根据苯的分子结构模型,写出苯的分子式_______,结构式____________,结构简式________________。
(2)向试管中加入3 mL酸性高锰酸钾溶液,再加入1 mL苯,振荡试管。观察到的实验现象是_______________。
(3)向试管中加入1 mL溴水,再加入3 mL苯,振荡试管。观察到的实验现象是_____________。
(4)你认为凯库勒提出的苯的分子结构符合实验事实吗?________,理由是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的原电池中,随着放电的进行,横坐标为时间,下列选项中(作纵坐标)满足图中曲线关系的是( )
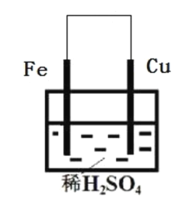
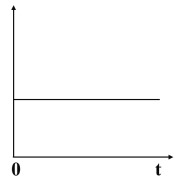
A.负极质量B.正极质量C.溶液质量D.转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.Fe溶于足量稀HNO3:3Fe+8H++2![]() =3Fe2++2NO↑+4H2O
=3Fe2++2NO↑+4H2O
B.NaHCO3溶液与NaOH溶液反应:![]() +OH-=CO2↑+H2O
+OH-=CO2↑+H2O
C.向NaAlO2溶液中加入过量的稀HCl:![]() +H++H2O=Al(OH)3↓
+H++H2O=Al(OH)3↓
D.氨水和醋酸溶液混合:NH3H2O+CH3COOH=NH4++CH3COO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是
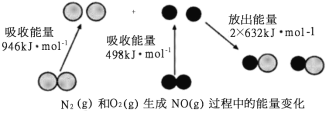
A. 1mol N2(g)和1mol O2(g)完全反应放出的能量为180kJ
B. 通常情况下,N2(g)和O2(g)混合能直接生成NO
C. 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量
D. NO是一种红棕色的气体,能与水反应生成硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和所得结论都正确的是
选项 | 实验 | 现象 | 结论 |
A | 向滴有酚酞的 Na2CO3 溶液中加入少量氯化钡固体,振荡 | 溶液红色变浅 | Na2CO3溶液存在水解平衡 |
B | 向X溶液中滴加几滴新制氯水,振 荡 ,再加入少量KSCN溶液 | 溶液变为红色 | X溶液中一定含有Fe2+ |
C | 检验食盐是否加碘( KIO3), 取少量食盐溶于水,用淀粉碘化钾试纸检验 | 试纸不变蓝 | 该食盐不含有KIO3 |
D | 向蛋白质溶液中加入CuSO4或( NH4)2 SO4 的饱和溶液 | 均有沉淀生成 | 蛋白质均发生了盐析 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组采取以下路线合成利胆药——柳胺酚。
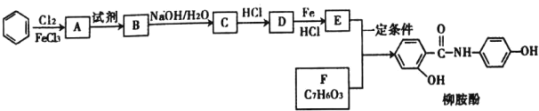
回答下列问题:
已知: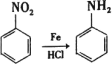
(1)对于柳胺酚,下列说法正确的是______________
A 有三种官能团 B 遇三氯化铁溶液显紫色
C 分子组成为C13H9NO3 D 1mol柳胺酚最多与3mol NaOH反应
(2)F的命名为______________;B中含氧官能团的名称为_________。
(3)写出化合物D的结构简式________________。
(4)写出E和F制取柳胺酚的化学反应方程式______________。
(5)写出同时符合下列条件的F的所有同分异构体的结构简式_______。
①能发生银镜反应 ②分子有四种不同化学环境的氢原子
(6)4-甲氧基乙酰苯胺是重要的精细化工中间体,写出由苯甲醚(![]() )制备4-甲氧基乙酰苯胺(
)制备4-甲氧基乙酰苯胺(![]() )的合成路线(注明试剂和条件)______。
)的合成路线(注明试剂和条件)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可表示为:Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。则正极的反应式是___________,负极的反应式是___________。放电时负极附近的溶液的碱性________(填“不变”、“变大”或“变小”)。
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。则正极的反应式是___________,负极的反应式是___________。放电时负极附近的溶液的碱性________(填“不变”、“变大”或“变小”)。
(2)一种熔融碳酸盐燃料电池原理示意如图所示:
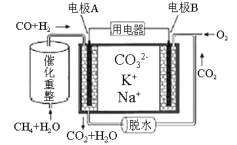
电池工作时,外电路上电流的方向应从电极________(填A或B)流向用电器。内电路中,CO32-向电极___________(填A或B)移动,电极A上CO参与的电极反应为___________。
(3)将两铂片插入KOH溶液中作为电极,在两极区分别通入甲醇(CH3OH)和氧气构成燃料电池,则通入甲醇的电极是原电池的____极,该极的电极反应式是____________,通入氧气的电极是原电池的____极,电极反应式是___________________。如果消耗甲醇160 g,假设化学能完全转化为电能,则转移电子的数目为_______________(用NA表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com