
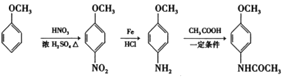
【题目】某课题组采取以下路线合成利胆药——柳胺酚。
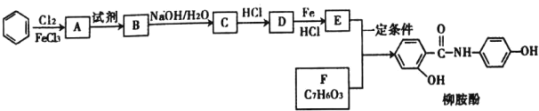
回答下列问题:
已知: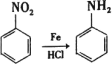
(1)对于柳胺酚,下列说法正确的是______________
A 有三种官能团 B 遇三氯化铁溶液显紫色
C 分子组成为C13H9NO3 D 1mol柳胺酚最多与3mol NaOH反应
(2)F的命名为______________;B中含氧官能团的名称为_________。
(3)写出化合物D的结构简式________________。
(4)写出E和F制取柳胺酚的化学反应方程式______________。
(5)写出同时符合下列条件的F的所有同分异构体的结构简式_______。
①能发生银镜反应 ②分子有四种不同化学环境的氢原子
(6)4-甲氧基乙酰苯胺是重要的精细化工中间体,写出由苯甲醚(![]() )制备4-甲氧基乙酰苯胺(
)制备4-甲氧基乙酰苯胺(![]() )的合成路线(注明试剂和条件)______。
)的合成路线(注明试剂和条件)______。
【答案】BD 邻羟基苯甲酸或2-羟基苯甲酸 硝基 ![]()
![]() +H2O
+H2O 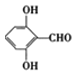 、
、 、
、![]() ,
, 
【解析】
苯和氯气发生取代反应生成A,A为![]() ;F中不饱和度=
;F中不饱和度=![]() =5,根据柳胺酚结构简式知,F中含有苯环和碳氧双键,所以F为
=5,根据柳胺酚结构简式知,F中含有苯环和碳氧双键,所以F为![]() ,E为
,E为![]() ;D和铁、HCl反应生成E,结合题给信息知,D结构简式为
;D和铁、HCl反应生成E,结合题给信息知,D结构简式为![]() ;A反应生成B,B和NaOH水溶液发生水解反应生成C,根据D结构简式知,A和浓硝酸发生取代反应生成B,B为
;A反应生成B,B和NaOH水溶液发生水解反应生成C,根据D结构简式知,A和浓硝酸发生取代反应生成B,B为![]() ,C为
,C为![]() ,据此解答。
,据此解答。
(1)A.柳胺酚有酰胺基、酚羟基2种官能团,A错误;
B.柳胺酚有酚羟基,遇三氯化铁溶液显紫色,B正确;
C.柳胺酚的分子式为:C13H11NO3,C错误;
D.酰胺基水解消耗1molNaOH,酚羟基共消耗2molNaOH,1mol柳胺酚最多与3mol NaOH反应,D正确;
综上所述,BD正确,故答案为:BD;
(2)F的结构简式为:![]() ,命名为:邻羟基苯甲酸或2-羟基苯甲酸,B的结构简式为:
,命名为:邻羟基苯甲酸或2-羟基苯甲酸,B的结构简式为:![]() ,含氯原子、硝基2种官能团,硝基为含氧官能团,故答案为:邻羟基苯甲酸或2-羟基苯甲酸;硝基;
,含氯原子、硝基2种官能团,硝基为含氧官能团,故答案为:邻羟基苯甲酸或2-羟基苯甲酸;硝基;
(3)由分析可知,D为:![]() ,故答案为:
,故答案为:![]() ;
;
(4)E和F脱水缩合生成柳胺酚,化学反应方程式为:![]() +H2O,故答案为:
+H2O,故答案为:![]() +H2O;
+H2O;
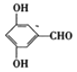
(5)F为![]() ,能发生银镜反应,则分子中含1个-CHO和2个-OH,或者含1个HCOO-和1个-OH,含1个-CHO和2个-OH共有6种,含1个HCOO-和1个-OH共有邻间对3种,共9种,其中分子有四种不同化学环境的氢原子的有3种,分别为:
,能发生银镜反应,则分子中含1个-CHO和2个-OH,或者含1个HCOO-和1个-OH,含1个-CHO和2个-OH共有6种,含1个HCOO-和1个-OH共有邻间对3种,共9种,其中分子有四种不同化学环境的氢原子的有3种,分别为: 、
、 、
、![]() ,故答案为:
,故答案为: 、
、 、
、![]() ;
;
(6)逆合成![]() 含酰胺基,可由
含酰胺基,可由![]() 和CH3COOH脱水缩合而来,
和CH3COOH脱水缩合而来,![]() 可由
可由![]() 还原硝基而来,
还原硝基而来,![]() 可由
可由![]() 硝化而来,整个流程为:
硝化而来,整个流程为: ,故答案为:
,故答案为: 。
。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以重晶石(BaSO4为主,含有钙等杂质)为原料,可按如下工艺生产碳酸钡:
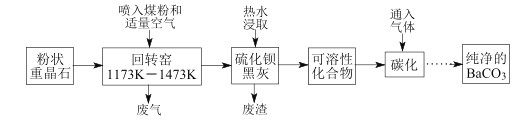
温度为1173K~1473K时回转窑中发生的主要反应:C+O2![]() CO2,C+CO2
CO2,C+CO2![]() 2CO;BaSO4+4C
2CO;BaSO4+4C![]() BaS+4CO↑,BaSO4+2C
BaS+4CO↑,BaSO4+2C![]() BaS+2CO2↑。
BaS+2CO2↑。
(1)煤粉的主要作用是______________。
(2)若回转窑中通过量空气,则BaCO3产率________(填“降低”、“升高”、“不变”)。
(3)用 90~95℃的热水浸取BaS转化为可溶性化合物时无气体生成,此过程反应的化学方程式__________________。
(4)在回转窑产生的废气,其中________可以在碳化过程得到重新利用;硫化钡黑灰热水浸取,保温后热过滤除去的残渣也可在其他工业生产中再利用,如废渣中的 CaSO4可作 ____________(写一种即可)。
(5)为了得到纯净的BaCO3,省略的操作是_____________________。
(6)已知反应BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq),某同学利用该反应在实验室模拟BaSO4转化为BaCO3的过程:若每次加入1 L 2 mol/L的Na2CO3溶液,至少需要____次,可以将0.3 mol BaSO4完全转化为BaCO3。[Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=5×10-9]
BaCO3(s)+SO42-(aq),某同学利用该反应在实验室模拟BaSO4转化为BaCO3的过程:若每次加入1 L 2 mol/L的Na2CO3溶液,至少需要____次,可以将0.3 mol BaSO4完全转化为BaCO3。[Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=5×10-9]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】让生态环境更秀美、人民生活更幸福!为此,天津冬季取暖许多家庭用上了清洁能源天然气。实际生产中天然气需要脱硫,在1200℃时,工艺中会发生下列反应:
①H2S(g)+![]() O2(g)=SO2(g)+H2O(g) ΔH1
O2(g)=SO2(g)+H2O(g) ΔH1
②2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) ΔH2
S2(g)+2H2O(g) ΔH2
③H2S(g)+![]() O2(g)=S(g)+H2O(g) ΔH3
O2(g)=S(g)+H2O(g) ΔH3
④2S(g)=S2(g) ΔH4
则ΔH4的正确表达式为( )
A.ΔH4=![]() (ΔH1 +ΔH2-3ΔH3)
(ΔH1 +ΔH2-3ΔH3)
B.ΔH4=![]() (3ΔH3-ΔH1-ΔH2)
(3ΔH3-ΔH1-ΔH2)
C.ΔH4=![]() (ΔH1-ΔH2+3ΔH3)
(ΔH1-ΔH2+3ΔH3)
D.ΔH4=![]() (ΔH1-ΔH2-3ΔH3)
(ΔH1-ΔH2-3ΔH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
(配制KMnO4标准溶液)如图是配制50 mL KMnO4标准溶液的过程示意图。


(1)请你观察图示判断,其中不正确的操作有(填序号)________。
(2)其中确定50 mL溶液体积的容器是(填名称)________。
(3)如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
(测定血液样品中Ca2+的浓度)抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
(4)已知草酸跟KMnO4溶液反应的离子方程式为:
2MnO4-+5H2C2O4+6H+===2Mnx++10CO2↑+8H2O则方程式中的x=________。
(5)经过计算,血液样品中Ca2+的浓度为________mg/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 100g 46%的乙醇溶液中,含H-O键的数目为7NA
B. pH=1的H3PO4溶液中,含有0.1NA个H+
C. 0.1mol Fe在足量氧气中燃烧,转移电子数为0.3NA
D. 1L 0.1mol·L-1的NH4Cl溶液中含有NH4+数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年12月以来,我国武汉等地相继暴发了新冠肺炎,为此我国政府和相关部门采取了多项措施控制疫情。75%乙醇和84消毒液等均能有效灭活新冠病毒。84消毒液的主要成分是次氯酸钠。设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.74.5g次氯酸钠中含有的离子数目为2NA
B.1mol次氯酸钠与足量盐酸反应转移的电子数为2NA
C.46g75%乙醇中含有的氧原子数大于6NA
D.利用氯气和氢氧化钠溶液反应制取0.1mol次氯酸钠需要消耗2.24L氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上合成氨,CO易与铁触媒作用导致铁触媒失去催化活性:Fe+5CO═Fe(CO)5.为了防止催化剂铁触媒中毒,要除去CO,发生的反应为Cu(NH3)2OOCCH3+CO+NH3═Cu(NH3)3(CO)OOCCH3.回答下列问题:
(1)下列氮原子的电子排布图表示的状态中,能量最低的是______(填字母序号)。
a.![]() b.
b.![]()
c.![]() d.
d.![]()
(2)写出CO的一种常见等电子体分子的结构式:______;C、N、O的第一电离能由大到小的顺序为______(用元素符号表示)。
(3)与O同族的元素还有S、Se、Te,它们氢化物的沸点大小为H2O>H2Te>H2Se>H2S,其原因是______。
(4)配合物[Cu(NH3)2]OOCCH3中,铜显+1价,则其中碳原子的杂化轨道类型是______,NH3分子的价电子对互斥理论模型是______。
(5)已知铜的一种氧化物Cu2O晶体的晶胞结构如图所示:
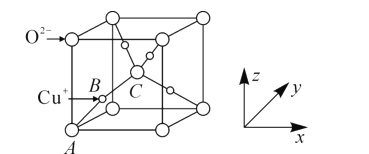
①若坐标参数A为(0,0,0),B为(![]() ),则C的坐标参数为______;
),则C的坐标参数为______;
②若阿伏加德罗常数为NA,该晶胞的边长为a pm,则晶体的密度为______gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中铋元素的数据见下图,下列说法正确的是

A. Bi元素的质量数是83 B. Bi元素的相对原子质量是209.0
C. Bi原子6p能级有一个未成对电子 D. Bi原子最外层有5个能量相同的电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com