
【题目】工业上合成氨,CO易与铁触媒作用导致铁触媒失去催化活性:Fe+5CO═Fe(CO)5.为了防止催化剂铁触媒中毒,要除去CO,发生的反应为Cu(NH3)2OOCCH3+CO+NH3═Cu(NH3)3(CO)OOCCH3.回答下列问题:
(1)下列氮原子的电子排布图表示的状态中,能量最低的是______(填字母序号)。
a.![]() b.
b.![]()
c.![]() d.
d.![]()
(2)写出CO的一种常见等电子体分子的结构式:______;C、N、O的第一电离能由大到小的顺序为______(用元素符号表示)。
(3)与O同族的元素还有S、Se、Te,它们氢化物的沸点大小为H2O>H2Te>H2Se>H2S,其原因是______。
(4)配合物[Cu(NH3)2]OOCCH3中,铜显+1价,则其中碳原子的杂化轨道类型是______,NH3分子的价电子对互斥理论模型是______。
(5)已知铜的一种氧化物Cu2O晶体的晶胞结构如图所示:
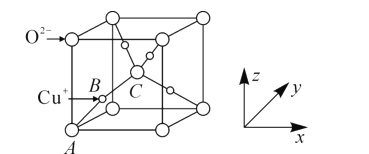
①若坐标参数A为(0,0,0),B为(![]() ),则C的坐标参数为______;
),则C的坐标参数为______;
②若阿伏加德罗常数为NA,该晶胞的边长为a pm,则晶体的密度为______gcm-3。
【答案】a N≡N N>O>C H2Te、H2Se、H2S均是分子晶体,相对分子质量逐渐减小,范德华力减小,所以沸点减小,而水分子中存在氢键,所以沸点最高 sp3、sp2 四面体形 ![]()
![]()
【解析】
(1)基态N的核外电子排布式为1s22s22p3,基态排布为能量最低的排布,电子排布图表示的状态中只有a项符合,故答案为:a;
(2)等电子体为原子总数相同,价电子总数也相同的微粒,与CO互为等电子体的一种分子为N2,其结构式为:N≡N;同周期主族元素,随着原子序数增大,第一电离能呈增大的趋势,但第ⅡA族和第ⅤA族元素反常,所以C、N、O的第一电离能由大到小的顺序为:N>O>C,故答案为:N≡N;N>O>C;
(3)H2Te、H2Se、H2S均是分子晶体,相对分子质量逐渐减小,范德华力减小,所以沸点减小,但由于氢键的作用力比范德华力强,氢键会使沸点异常升高,会导致H2O的沸点异常的高,所以沸点大小为H2O>H2Te>H2Se>H2S,故答案为:H2Te、H2Se、H2S均是分子晶体,相对分子质量逐渐减小,范德华力减小,所以沸点减小,而水分子中存在氢键,所以沸点最高;
(4)甲基中碳原子形成4个σ键,没有孤电子对,杂化轨道数目为4,碳原子杂化方式为sp3,而羰基中C原子形成3个σ键,没有孤电子对,杂化轨道数目为3,碳原子杂化方式为sp2;NH3中N原子形成3个N-H键,含有1对孤对电子,价层电子对数=3+1=4,价电子对互斥理论模型是四面体形,故答案为:sp3、sp2;四面体形;
(5)①根据晶胞结构分析,C位于晶胞体心,则C的原子坐标为:![]() ,故答案为:
,故答案为:![]() ;
;
②1mol晶胞,即有NA个晶胞,质量为m=2×(64×2+16)g=144×2g,所以密度为ρ=![]() ,故答案为:
,故答案为:![]() 。
。


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】下图所示的原电池中,随着放电的进行,横坐标为时间,下列选项中(作纵坐标)满足图中曲线关系的是( )
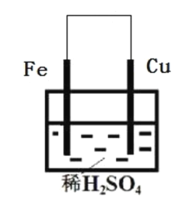
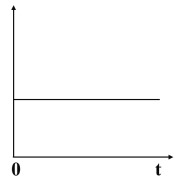
A.负极质量B.正极质量C.溶液质量D.转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组采取以下路线合成利胆药——柳胺酚。
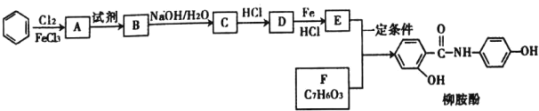
回答下列问题:
已知: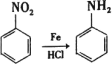
(1)对于柳胺酚,下列说法正确的是______________
A 有三种官能团 B 遇三氯化铁溶液显紫色
C 分子组成为C13H9NO3 D 1mol柳胺酚最多与3mol NaOH反应
(2)F的命名为______________;B中含氧官能团的名称为_________。
(3)写出化合物D的结构简式________________。
(4)写出E和F制取柳胺酚的化学反应方程式______________。
(5)写出同时符合下列条件的F的所有同分异构体的结构简式_______。
①能发生银镜反应 ②分子有四种不同化学环境的氢原子
(6)4-甲氧基乙酰苯胺是重要的精细化工中间体,写出由苯甲醚(![]() )制备4-甲氧基乙酰苯胺(
)制备4-甲氧基乙酰苯胺(![]() )的合成路线(注明试剂和条件)______。
)的合成路线(注明试剂和条件)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质稀溶液相互反应.无论前者滴入后者,还是后者滴入前者,反应现象相同,且离子方程式也相同的是
A. Ba(HCO3)2溶液与Ba(OH)2溶液 B. NaAlO2溶液与稀硫酸溶液
C. Ca(HCO3)2溶液与NaOH溶液 D. 氨水与硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
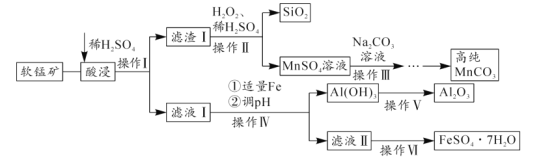
【题目】软锰矿的主要成分为MnO2,还含有SiO2、Al2O3、Fe2O3、FeO等杂质。软锰矿经过综合利用,可制备碳酸锰、氧化铝及绿矾( FeSO47H2O),其制备过程如图:
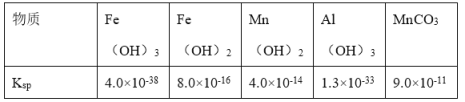
部分物质的Ksp如表:
回答下列问题:
(1)操作I中需要的仪器有______(填字母序号)。
a.蒸发皿 b.酒精灯c.漏斗 d.玻璃棒 e.烧杯
(2)操作Ⅱ中反应的离子方程式为______。
(3)操作Ⅲ中也可用NaHCO3与MnSO4溶液反应制备碳酸锰,其反应的离子方程式为______。
(4)操作Ⅳ中加入适量Fe的目的是______;当调节pH=______时(结果保留整数),可确定Al(OH)3完全沉淀。(已知:完全沉淀后,溶液中离子浓度不高于10-5molL-1)
(5)操作Ⅵ中一般要加入稀硫酸,目的是______,然后______、冷却结晶、______、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )

A. 溶液中一定不含CO32﹣,可能含有SO42-和NO3-
B. 溶液中n(NH4+)="0.2" mol
C. 溶液中的阳离子只有H+、Mg2+、Al3+
D. n(H+)︰n(Al3+)︰n(Mg2+)=1︰1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可表示为:Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。则正极的反应式是___________,负极的反应式是___________。放电时负极附近的溶液的碱性________(填“不变”、“变大”或“变小”)。
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。则正极的反应式是___________,负极的反应式是___________。放电时负极附近的溶液的碱性________(填“不变”、“变大”或“变小”)。
(2)一种熔融碳酸盐燃料电池原理示意如图所示:
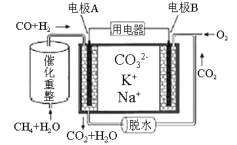
电池工作时,外电路上电流的方向应从电极________(填A或B)流向用电器。内电路中,CO32-向电极___________(填A或B)移动,电极A上CO参与的电极反应为___________。
(3)将两铂片插入KOH溶液中作为电极,在两极区分别通入甲醇(CH3OH)和氧气构成燃料电池,则通入甲醇的电极是原电池的____极,该极的电极反应式是____________,通入氧气的电极是原电池的____极,电极反应式是___________________。如果消耗甲醇160 g,假设化学能完全转化为电能,则转移电子的数目为_______________(用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产、生活中有广泛应用。
(1)铁原子核外有__________种运动状态不同的电子,Fe3+基态核外电子排布式为_______________。
(2)实验室常用K3[Fe(CN)6]检验Fe2+,[Fe(CN)6]3-中三种元素电负性由大到小的顺序为________(用元素符号表示),CN-中σ键与π键的数目比n(σ)∶n(π)=__________;HCN中C原子轨道的杂化类型为__________。HCN的沸点为25.7℃,既远大于N2的沸点(-195.8℃)也大于HCl的沸点(-85℃)的原因是__________。
(3)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子(Fe2Cl6)存在,该双聚分子的结构式为________,其中Fe的配位数为_____________。

(4)铁氮化合物(Fe4N)在磁记录材料领域有着广泛的应用前景,其晶胞如上图所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中b位置Fe原子的坐标为(0,![]() ,
,![]() )、(
)、(![]() ,0,
,0,![]() )和(
)和(![]() ,
,![]() ,0),则a位置Fe原子和N原子的坐标分别为__________、__________。N与Fe原子之间最短距离a pm。设阿伏加德罗常数的值为NA,则该铁氮化合物的密度是__________g·cm-3(列出计算表达式)。
,0),则a位置Fe原子和N原子的坐标分别为__________、__________。N与Fe原子之间最短距离a pm。设阿伏加德罗常数的值为NA,则该铁氮化合物的密度是__________g·cm-3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年,嫦娥四号成功在月球着陆。探测器上的五星红旗由一类特殊的聚酰亚胺(化合物H)制成。以下是H的合成路线:
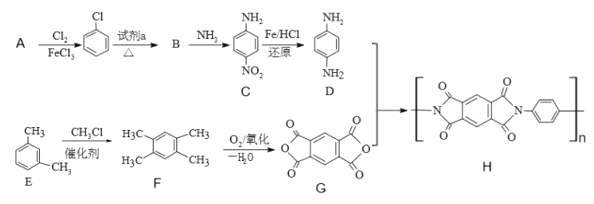
已知: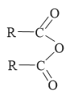 +R’—NH2
+R’—NH2![]() +RCOOH
+RCOOH
(1)A结构简式是____。
(2)试剂a是_____。
(3)B→C的反应类型______;C中含有的官能团名称为_____。
(4)写出D+G→H的化学反应方程式_____。
(5)写出一种苯环上一氯代物有三种,核磁共振氢谱为6:4:2:1:1的F的同分异构体的结构简式_____。(不考虑立体异构)
(6)设计由CH3CH2OH、![]() 合成
合成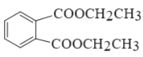 的合成路线_____。(其它物质自选)。
的合成路线_____。(其它物质自选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com