
【题目】让生态环境更秀美、人民生活更幸福!为此,天津冬季取暖许多家庭用上了清洁能源天然气。实际生产中天然气需要脱硫,在1200℃时,工艺中会发生下列反应:
①H2S(g)+![]() O2(g)=SO2(g)+H2O(g) ΔH1
O2(g)=SO2(g)+H2O(g) ΔH1
②2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) ΔH2
S2(g)+2H2O(g) ΔH2
③H2S(g)+![]() O2(g)=S(g)+H2O(g) ΔH3
O2(g)=S(g)+H2O(g) ΔH3
④2S(g)=S2(g) ΔH4
则ΔH4的正确表达式为( )
A.ΔH4=![]() (ΔH1 +ΔH2-3ΔH3)
(ΔH1 +ΔH2-3ΔH3)
B.ΔH4=![]() (3ΔH3-ΔH1-ΔH2)
(3ΔH3-ΔH1-ΔH2)
C.ΔH4=![]() (ΔH1-ΔH2+3ΔH3)
(ΔH1-ΔH2+3ΔH3)
D.ΔH4=![]() (ΔH1-ΔH2-3ΔH3)
(ΔH1-ΔH2-3ΔH3)
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为19。Y原子的电子层数与最外层电子数的比等于1/3,Z原子最外层电子数与内层电子数的比为1:10。下列说法正确的是
A. 非金属性:Y<X<W
B. 简单气态氢化物的热稳定性:Y<X
C. 化合物ZW、XY中化学键类型相同
D. X、W的最高价氧化物的水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的原电池中,随着放电的进行,横坐标为时间,下列选项中(作纵坐标)满足图中曲线关系的是( )
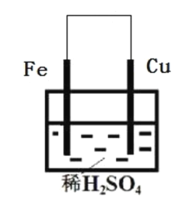
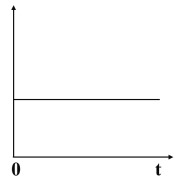
A.负极质量B.正极质量C.溶液质量D.转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是
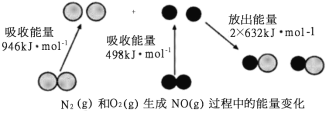
A. 1mol N2(g)和1mol O2(g)完全反应放出的能量为180kJ
B. 通常情况下,N2(g)和O2(g)混合能直接生成NO
C. 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量
D. NO是一种红棕色的气体,能与水反应生成硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和所得结论都正确的是
选项 | 实验 | 现象 | 结论 |
A | 向滴有酚酞的 Na2CO3 溶液中加入少量氯化钡固体,振荡 | 溶液红色变浅 | Na2CO3溶液存在水解平衡 |
B | 向X溶液中滴加几滴新制氯水,振 荡 ,再加入少量KSCN溶液 | 溶液变为红色 | X溶液中一定含有Fe2+ |
C | 检验食盐是否加碘( KIO3), 取少量食盐溶于水,用淀粉碘化钾试纸检验 | 试纸不变蓝 | 该食盐不含有KIO3 |
D | 向蛋白质溶液中加入CuSO4或( NH4)2 SO4 的饱和溶液 | 均有沉淀生成 | 蛋白质均发生了盐析 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物) 为原料制备Mg CO3·3H2O。实验过程如下:

(1)酸溶过程中主要反应的热化学方程式为:
MgCO3(s)+2H+(aq)=Mg2+(aq)+CO2(g)+H2O H = -50.4kJ·mol-1
Mg2SiO4(s) +4 H+(aq)=2 Mg2+(aq) +H2SiO3(s) + H2O(l) H =-225.4kJ··mol-1
向Mg2SiO4悬浊液中通入CO2析出H2SiO3的热化学方程式为__________,该反应能正向进行的热力学原因是_________。该反应的平衡常数表达式为__________。
(2)对氧化后的溶液,加入萃取剂磷酸二异辛酯(C16H35O4P)的煤油溶液,并调节pH为1.4~4.3,萃取剂的体积约为水溶液的0.5倍,充分振荡、静止、分层(上层为含三价铁的有机层),分液。向分液得到的有机层加硫酸反萃取得到硫酸铁溶液,从而与有机层分离。萃取反应为:Fe2(SO4)3(水层)+6HA(有机层)=2FeA3(有机层)+3H2SO4(水层)
①提高萃取效率的措施有__________。
A 适当提高萃取剂的浓度 B 适当提高溶液酸度
C 充分振荡,多次萃取 D 不断地从下层排除出有机层
②在反萃取中加硫酸的作用是___________。
(3)萃取后的水溶液制备Mg CO3·3H2O的实验方案:滴加氨水调节溶液的pH在一定范围内,过滤。向滤液中滴加Na2 CO3溶液,搅拌、静置、过滤,用水洗涤固体2~3次,在50℃下干燥,得到Mg CO3·3H2O。[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。
①调节溶液pH的范围____________。
②判断向滤液中滴加Na2CO3溶液过量的方法__________。
(4)从废渣制备Mg CO3·3H2O的整体实验方案看,酸溶时所加H2SO4不宜过量太多的原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组采取以下路线合成利胆药——柳胺酚。
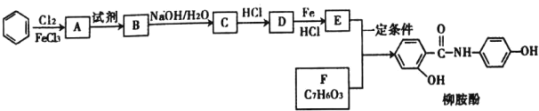
回答下列问题:
已知: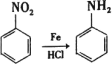
(1)对于柳胺酚,下列说法正确的是______________
A 有三种官能团 B 遇三氯化铁溶液显紫色
C 分子组成为C13H9NO3 D 1mol柳胺酚最多与3mol NaOH反应
(2)F的命名为______________;B中含氧官能团的名称为_________。
(3)写出化合物D的结构简式________________。
(4)写出E和F制取柳胺酚的化学反应方程式______________。
(5)写出同时符合下列条件的F的所有同分异构体的结构简式_______。
①能发生银镜反应 ②分子有四种不同化学环境的氢原子
(6)4-甲氧基乙酰苯胺是重要的精细化工中间体,写出由苯甲醚(![]() )制备4-甲氧基乙酰苯胺(
)制备4-甲氧基乙酰苯胺(![]() )的合成路线(注明试剂和条件)______。
)的合成路线(注明试剂和条件)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质稀溶液相互反应.无论前者滴入后者,还是后者滴入前者,反应现象相同,且离子方程式也相同的是
A. Ba(HCO3)2溶液与Ba(OH)2溶液 B. NaAlO2溶液与稀硫酸溶液
C. Ca(HCO3)2溶液与NaOH溶液 D. 氨水与硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产、生活中有广泛应用。
(1)铁原子核外有__________种运动状态不同的电子,Fe3+基态核外电子排布式为_______________。
(2)实验室常用K3[Fe(CN)6]检验Fe2+,[Fe(CN)6]3-中三种元素电负性由大到小的顺序为________(用元素符号表示),CN-中σ键与π键的数目比n(σ)∶n(π)=__________;HCN中C原子轨道的杂化类型为__________。HCN的沸点为25.7℃,既远大于N2的沸点(-195.8℃)也大于HCl的沸点(-85℃)的原因是__________。
(3)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子(Fe2Cl6)存在,该双聚分子的结构式为________,其中Fe的配位数为_____________。

(4)铁氮化合物(Fe4N)在磁记录材料领域有着广泛的应用前景,其晶胞如上图所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中b位置Fe原子的坐标为(0,![]() ,
,![]() )、(
)、(![]() ,0,
,0,![]() )和(
)和(![]() ,
,![]() ,0),则a位置Fe原子和N原子的坐标分别为__________、__________。N与Fe原子之间最短距离a pm。设阿伏加德罗常数的值为NA,则该铁氮化合物的密度是__________g·cm-3(列出计算表达式)。
,0),则a位置Fe原子和N原子的坐标分别为__________、__________。N与Fe原子之间最短距离a pm。设阿伏加德罗常数的值为NA,则该铁氮化合物的密度是__________g·cm-3(列出计算表达式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com