
【题目】图表示可逆反应A(s)+B(g) n C(g);ΔH=Q kJ·mol1,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述中一定正确的
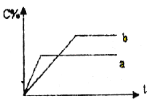
A. 若条件为催化剂,则a表示有催化剂,b表示没有催化剂
B. 只改变温度,则a比b的温度高,且Q>0
C. 只改变压强,则a比b的压强大,n>2
D. 由图象可以作出判断,反应一定从正反应方向开始
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】五氧化二钒广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。为回收利用含钒催化剂,研制了一种利用废催化剂(含有V2O5、VOSO4、不溶性硅酸盐)回收V2O5的新工艺流程如图:
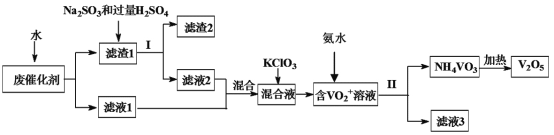
已知:(1)部分含钒物质常温下在水中的溶解性如表所示:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(2)VO2++OH-![]() VO3-+H2O
VO3-+H2O
回答下列问题:
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,在不加试剂情况下,可以采取的措施为__(写一条)。
(2)滤液1和滤液2中钒的存在形式相同,其存在形式为__(填离子符号)。
(3)每生成1mol(VO2)2SO4时转移电子的数目为___。
(4)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应的离子方程式为___。
(5)结合化学用语,用平衡移动原理解释加入氨水的一种作用为__。
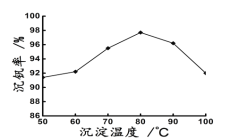
(6)新工艺流程的最后,钒以NH4VO3的形式沉淀出来;如图中横坐标表示反应II的温度,纵坐标表示沉钒率,沉钒率是指NH4VO3沉淀中V元素的质量和废催化剂中V元素的质量之比,也即是钒的回收率。请解释图中温度超过80℃以后,沉钒率下降的可能原因是___。
(7)该工艺流程中可以循环利用的物质为__。
(8)若实验室用的原料中V2O5占6%(原料中的所有钒已换算成V2O5)。取100克该废钒催化剂按工业生产的步骤进行实验。当加入100mL0.1mol/L的KClO3溶液时,溶液中的钒恰好被完全处理,假设与KClO3反应后的操作步骤中钒没有损失,则该实验中钒的回收率是__(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀 |
B | CO2通入BaCl2溶液中 | 有白色沉淀出现 | 生成了BaCO3沉淀 |
C | Al箔插入稀 | 无现象 | Al箔表面被 |
D | 用玻璃棒蘸取浓硝酸点到蓝色石蕊试纸上 | 试纸先变红色后褪色 | 浓硝酸有酸性和氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )


A. ①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0
B. ②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
C. ③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D. ④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予了锂离子电池领域做出巨大贡献的三位科学家。某锂离子电池![]() 为负极,
为负极,![]() 为正极,锂盐有机溶液作电解质溶液,电池反应为
为正极,锂盐有机溶液作电解质溶液,电池反应为![]() 则下列有关说法正确的是
则下列有关说法正确的是
A.金属锂的密度、熔点和硬度均比同族的碱金属低
B.该锂离子电池可用乙醇作有机溶剂
C.电池放电时,Li+从正极流向负极
D.电池充电时,阳极的电极反应式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下反应:A2(g)+3 B2(g)![]() 2 AB3(g) (每生成2 mol AB3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol A2和3 mol B2,达平衡时放出热量为Q1,②通入2 mol A2和6 mol B2,达平衡时放出热量为Q2,则下列关系正确的是
2 AB3(g) (每生成2 mol AB3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol A2和3 mol B2,达平衡时放出热量为Q1,②通入2 mol A2和6 mol B2,达平衡时放出热量为Q2,则下列关系正确的是
A.Q2 = 2 Q1 B.2Q1 < Q2
C.Q1 < Q2 < 92.4 kJ D.Q1 = Q2 < 92.4 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列问题:
(1)10Be和9Be______________。
a.是同一种原子 b.具有相同的中子数
c.具有相同的化学性质 d.具有相同的核外电子排布
(2)有下列微粒或物质:
①![]() O、
O、![]() O、
O、![]() O ②H2O、D2O ③石墨、金刚石 ④H2、D2、T2 ⑤H、D、T ⑥
O ②H2O、D2O ③石墨、金刚石 ④H2、D2、T2 ⑤H、D、T ⑥![]() K、
K、![]() Ca、
Ca、![]() Ar,回答下列问题:
Ar,回答下列问题:
a.互为同位素的是______________;
b.互为同素异形体的是______________;
c.由①和⑤中的微粒能结合成水,可得水分子的种数为__________种;可得相对分子质量不同的水分子种数为__________种,相对分子质量最大的是____________(写化学式)。
(3)![]() H2
H2![]() O的摩尔质量为____________,相同质量的
O的摩尔质量为____________,相同质量的![]() H2
H2![]() O与
O与![]() H2
H2![]() O所含质子数之比为______,中子数之比为__________。
O所含质子数之比为______,中子数之比为__________。
(4)电解相同质量的![]() H2
H2![]() O和
O和![]() H2
H2![]() O时产生的氢气在同温同压下体积之比为__________,质量之比为__________。
O时产生的氢气在同温同压下体积之比为__________,质量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下列氧化还原反应,指出氧化剂和还原剂、氧化产物和还原产物。
(1)CuO+CO![]() Cu+CO2
Cu+CO2
氧化剂:__,还原剂:__,氧化产物:__,还原产物:__。
(2)2Al+3H2SO4=Al2(SO4)3+3H2↑
氧化剂:__,还原剂:__,氧化产物:__,还原产物:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,几种难溶金属氢氧化物分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度的变化如图所示。下列说法正确的是( )
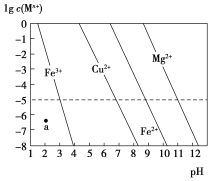
A.a点代表Fe(OH)3的饱和溶液
B.Ksp[Cu(OH)2]<Ksp[Fe(OH)2]
C.在pH=7的溶液中,Cu2+、Mg2+、Fe2+能大量共存
D.向各含0.1mol·L-1Cu2+、Mg2+、Fe2+混合溶液中,逐滴滴加稀NaOH溶液,Mg2+最先沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com