
【题目】CO2是造成全球气候变暖的主要气体,同时也是一种来源丰富、价格低廉的碳资源。中科院福建物构所谢奎及其团队利用电能将CO2高效转化为CO,CO和H2可生产优质燃料和多种化工产品,实现碳资源的循环利用。
(1)已知反应过程中能量变化如下表和曲线图所示:
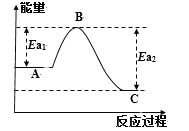
反应 | A | C | Ea1(kJ/mol) | Ea2(kJ/mol) | ΔH(kJ/mol) |
① | 2CO(g)+O2(g) | 2CO2(g) | ? | 2389 | -566 |
② | 2H2(g)+O2(g) | 2H2O(l) | 1480 | ? | -571.6 |
③ | 2CH3OH(l)+3O2(g) | 2CO2(g)+4H2O(l) | 3026 | 4478 | ΔH3 |
反应③ 的ΔH3=_________kJ/mol。
CO(g) + 2H2(g) ![]() CH3OH(l) ΔH4=_______kJ/mol;此反应中,有利于提高H2平衡转化率的条件是_______(填字母)。
CH3OH(l) ΔH4=_______kJ/mol;此反应中,有利于提高H2平衡转化率的条件是_______(填字母)。
A.高温低压 B.低温高压
C.高温高压 D.低温低压
(2)在不同的电压下,CO2、H2O混合电解转化为CO、H2的电流效率如图所示(注:电流效率![]() ×100%):
×100%):

①由图可知生成CO和H2有相互/span>_______(填“促进”、“抑制”或“无影响”)作用。
②用此法生产的CO和H2合成CH3OH,为使CO和H2利用率最高,电解时应控制电压在________ V左右(选填5、15、23、25、30)。
(3)在300℃时,将0.60molCO、1.40molH2充入4L密闭容器中,在恒温恒容下发生反应CO(g) + 2H2(g) ![]() CH3OH(g) △H<0,甲醇的物质的量浓度随时间的变化如图所示:
CH3OH(g) △H<0,甲醇的物质的量浓度随时间的变化如图所示:

①图中判断反应到达平衡状态的依据是________________。
② 5min内H2的平均反应速率v(H2) =________mol/(Lmin)。
③ 若在500℃条件下,将1.00molCO、0.50mol H2和0.50mol CH3OH充入容积为2L的密闭容器中,此时反应将_______(填字母)。
A.正反应方向反应 B.逆反应方向反应
C.达到平衡 D.无法判断
【答案】-1452 -128.6 B 抑制 25 CH3OH浓度保持不变或不再随时间变化 0.02 B
【解析】
(1)根据ΔH3=反应物的活化能-生成物的活化能计算反应③的ΔH3,然后根据盖斯定律计算ΔH4;根据影响化学平衡的因素分析判断提高H2平衡转化率的方法;
(2)①由图可知,生成CO越少,生成H2越多,据此解答;
②根据方程式CO(g) + 2H2(g) ![]() CH3OH(l)分析判断使CO和H2利用率最高的电压;
CH3OH(l)分析判断使CO和H2利用率最高的电压;
(3)①根据反应到达平衡状态的特征分析解答;
② 首先计算5min内甲醇的平均反应速率,再根据化学反应速率之比=化学计量数之比计算v(H2);
③先计算300℃时的平衡常数K,该反应为放热反应,升高温度,平衡逆向移动,K减小;再计算500℃条件下,将1.00molCO、0.50mol H2和0.50mol CH3OH充入容积为2L的密闭容器中的Qc,根据Qc与K的大小,判断平衡移动的方向。
(1)反应③的ΔH3=反应物的活化能-生成物的活化能=(3026)-(4478)=-1452 kJ/mol;根据表格数据,①2CO(g)+O2(g)= 2CO2(g) ΔH1=-566 kJ/mol,②2H2(g)+O2(g)= 2H2O(l) ΔH2=-571.6 kJ/mol,③2CH3OH(l)+3O2(g)→2CO2(g)+4H2O(l) ΔH3=-1452 kJ/mol,根据盖斯定律,将(①+②×2-③)×![]() 得:CO(g) + 2H2(g)
得:CO(g) + 2H2(g) ![]() CH3OH(l) ΔH4=
CH3OH(l) ΔH4=![]() ×[(-566)+(-571.6)×2-(-1452)]kJ/mol=-128.6 kJ/mol;该反应为气体体积减小的放热反应,低温高压能够使平衡正向移动,有利于提高H2平衡转化率,故答案为:-1452; -128.6;B;
×[(-566)+(-571.6)×2-(-1452)]kJ/mol=-128.6 kJ/mol;该反应为气体体积减小的放热反应,低温高压能够使平衡正向移动,有利于提高H2平衡转化率,故答案为:-1452; -128.6;B;
(2)①由图可知,生成CO越少,生成H2越多,生成CO和H2有相互抑制的作用,故答案为:抑制;
②根据方程式CO(g) + 2H2(g) ![]() CH3OH(l)可知,为使CO和H2利用率最高,电解时应控制电压在25 V左右,故答案为:25;
CH3OH(l)可知,为使CO和H2利用率最高,电解时应控制电压在25 V左右,故答案为:25;
(3)①5min时CH3OH浓度保持不变或不再随时间变化,说明反应到达平衡状态,故答案为:CH3OH浓度保持不变或不再随时间变化;
② 5min内甲醇的平均反应速率=![]() =0.01 mol/(Lmin),则v(H2) =2v (CH3OH)= 0.02mol/(Lmin) ,故答案为:0.02;
=0.01 mol/(Lmin),则v(H2) =2v (CH3OH)= 0.02mol/(Lmin) ,故答案为:0.02;
③在300℃时,将0.60molCO、1.40molH2充入4L密闭容器中,平衡时甲醇的物质的量浓度为0.05 mol/L,物质的量为0.2mol,则反应的CO和H2分别为0.2mol、0.4mol,平衡时CO和H2物质的量浓度分别为![]() mol/L = 0.1mol/L,
mol/L = 0.1mol/L,![]() mol/L = 0.25mol/L,此时平衡常数K=
mol/L = 0.25mol/L,此时平衡常数K=![]() =8,该反应为放热反应,升高温度,平衡逆向移动,K减小;在500℃条件下,将1.00molCO、0.50mol H2和0.50mol CH3OH充入容积为2L的密闭容器中,此时CO、H2和CH3OH的浓度分别为0.5 mol/L、0.25 mol/L、0.25 mol/L,Qc=
=8,该反应为放热反应,升高温度,平衡逆向移动,K减小;在500℃条件下,将1.00molCO、0.50mol H2和0.50mol CH3OH充入容积为2L的密闭容器中,此时CO、H2和CH3OH的浓度分别为0.5 mol/L、0.25 mol/L、0.25 mol/L,Qc=![]() =8>K,平衡逆向移动,故选B
=8>K,平衡逆向移动,故选B


科目:高中化学 来源: 题型:
【题目】已知某种微生物燃料电池工作原理如图所示。下列有关该电池的说法中,正确的是
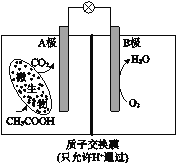
A.外电路电子从B极移向A极
B.溶液中H+由B极区移向A极区
C.电池工作一段时间后B极区溶液的pH减小
D.A极电极反应式为:CH3COOH - 8e-+2H2O=2CO2 +8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)下列关于金属及金属键的说法不正确的是______。(填字母代号)
a.金属键没有方向性与饱和性
b.金属键是金属原子与自由电子间的相互作用
c.金属熔沸点不同的原因可以用金属键强弱解释
d.电子气理论可解释金属材料的延展性,不能解释金属有良好的导电性
(2)钒广泛用于催化及钢铁工业,基态钒原子的价层电子排布图为_________________。
(3)二茂铁又叫双环戊二烯基铁[Fe(C5H5)2],熔点是172.5~173 ℃,100 ℃以上升华,二茂铁属于_____晶体。已知分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() )。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
)。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
(4)铜可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若要确定[Cu(NH3)4(H2O)2]SO4是晶体还是非晶体,最科学的方法是对其进行______实验,其中阴离子的空间构型是_____,该化合物加热时首先失去的组分是H2O,原因是_______________________。
(5)最近发现,只含镁、镍和碳三种元素的晶体也具有超导性,该物质形成的晶体的立方晶胞结构如图所示。
①与Mg紧邻的Ni有________个。
②原子坐标参数可表示晶胞内部各原子的相对位置。该晶胞中原子的坐标参数为a为(0,0,0);b为(1/2,1/2,0);d为(1,1,1)。则c原子的坐标参数为_______。
③若晶胞中Ni、Mg之间的最短距离为a pm,阿伏加德罗常数的值为NA,则晶体的密度ρ=______g·cm-3(用含a、NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅晶体是空间立体网状结构,如图所示:

关于二氧化硅晶体的下列说法中,正确的是( )
A. 1 mol SiO2晶体中Si—O键为2 mol
B. 二氧化硅晶体的分子式是SiO2
C. 晶体中Si、O原子最外电子层都满足8电子结构
D. 晶体中最小环上的原子数为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,且原子序数依次增大,其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)比E核外电子数少5的元素的原子核外电子排布式是 ,A、B、C、D的第一电离能由小到大的顺序为 。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是 。
(3)A的氢化物属于 (填“极性”或“非极性”)分子,D的低价氧化物分子的立体构型是 。
(4)A、E形成的某种化合物的晶胞结构如图所示,则其化学式为 (每个球均表示1个原子)。
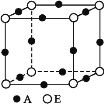
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq),下列说法错误的是 ( )
A. MnS的![]() 比CuS的
比CuS的![]() 大
大
B. 该反应达到平衡时:![]()
C. 往平衡体系中加入少量![]() 固体后,
固体后,![]() 变大
变大
D. ![]() 的浊液中加入少量可溶性
的浊液中加入少量可溶性![]() 固体后,
固体后,![]() 变大
变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+ H2O(g)![]() CO2 (g)+ H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
CO2 (g)+ H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是( )
A. 反应在t1min内的平均速率为![]()
B. 保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时n(CO2)= 0.40mol
C. 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时H2O转化率增大
D. 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量的浓度和混合液的pH如下表所示:
实验编号 | HA的物质的量浓度(mol·L-1) | NaOH的物质的量浓度(mol·L-1) | 混合后溶液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还弱酸? 。
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)= mol/L。
Ⅱ.某二元酸(分子式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB-![]() H++B2-
H++B2-
回答下列问题:
(5)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 。
A.c(B2-)+c(HB-)=0.1mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图回答,下列说法不正确的是

A. 此装置用于铁表面镀铜时,a为铁
B. 此装置用于电镀铜时,硫酸铜溶液的浓度不变
C. 燃料电池中正极反应为O2+4e-+4H+![]() 2H2O
2H2O
D. 若用该装置进行粗铜的精炼,当有1 mol水生成时,可得到64 g精铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com