
【题目】T℃时,向2 L恒容密闭容器中充入1 mol NO2与2 mol SO2发生如下反应:
NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1。
SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1。
(1)下列能说明该反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗n mol SO3的同时生成n mol NO2
(2)反应进行到20 s 时,测得反应速率v(NO) =" 0.005" mol·L-1·s-1,则消耗的NO2为 mol。
(3)下列措施能使反应加快的是 (仅改变一个条件)
a.降低温度 b.缩小容积 c.使用效率更高的催化剂
(4)若上述容器为绝热容器(与外界无热交换),则到达平衡所需时间将 。
a.延长 b.缩短 c.不变 d.无法确定
【答案】(1)b ;(2)0.2 ;(3)b、c ;(4)b。
【解析】试题分析:反应NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1是反应前后气体体积不变的放热反应。a.由于反应前后气体的体积不变,因此无论反应是否达到平衡,体系压强都保持不变,故不能据此判断反映是否处于平衡状态,错误;b.在混合气体中只有NO2是有色气体,因此混合气体颜色保持不变,则证明反应处于平衡状态,正确;c.SO3和NO都是生成物,二者的物质的量的比就是方程式的系数比,因此二者的体积积比保持不变不能判断反应处于平衡状态,错误;d.每消耗n mol SO3的同时生成n mol NO2,这都表示反应逆向进行,因此不能证明反应处于平衡状态,错误。(2)反应进行到20 s 时,测得反应速率v(NO) =" 0.005" mol·L-1·s-1,由于v(NO2):v(NO)=1:1,所以反应消耗的NO2的物质的量是为n(NO2) =" 0.005" mol·L-1·s-1×2 L×20s=0.2mol;(3)a.降低温度,反应速率减慢,错误;b.缩小容积,物质的浓度增大,反应速率加快,正确;c.使用效率更高的催化剂,可以是化学反应速率大大加快,正确。(4)该反应为放热反应,容器绝热会使容器内温度升高,反应速率加快,到达平衡的时间缩短,故b正确。
SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1是反应前后气体体积不变的放热反应。a.由于反应前后气体的体积不变,因此无论反应是否达到平衡,体系压强都保持不变,故不能据此判断反映是否处于平衡状态,错误;b.在混合气体中只有NO2是有色气体,因此混合气体颜色保持不变,则证明反应处于平衡状态,正确;c.SO3和NO都是生成物,二者的物质的量的比就是方程式的系数比,因此二者的体积积比保持不变不能判断反应处于平衡状态,错误;d.每消耗n mol SO3的同时生成n mol NO2,这都表示反应逆向进行,因此不能证明反应处于平衡状态,错误。(2)反应进行到20 s 时,测得反应速率v(NO) =" 0.005" mol·L-1·s-1,由于v(NO2):v(NO)=1:1,所以反应消耗的NO2的物质的量是为n(NO2) =" 0.005" mol·L-1·s-1×2 L×20s=0.2mol;(3)a.降低温度,反应速率减慢,错误;b.缩小容积,物质的浓度增大,反应速率加快,正确;c.使用效率更高的催化剂,可以是化学反应速率大大加快,正确。(4)该反应为放热反应,容器绝热会使容器内温度升高,反应速率加快,到达平衡的时间缩短,故b正确。


科目:高中化学 来源: 题型:
【题目】下列有关甲烷的说法正确的是
A.甲烷不能发生氧化反应B.甲烷中的共价键都是极性共价键
C.甲烷和四氯化碳都易溶于水D.甲烷中所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有H2SO4的H2O2溶液中滴加一定量的KMnO4溶液,反应开始后,溶液中Mn2+的浓度c将随时间t的变化而变化。某学生在做实验前认为,Mn2+的浓度c与时间t的关系如图甲所示,做完实验后,得到的结果如图乙所示。请回答下列问题:
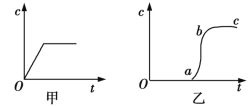
(1)写出H2O2与KMnO4反应的化学方程式 。
(2)Oa段的意义为 。
(3)ab段的意义及ab段陡的原因为 。
(4)bc段的意义为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些项不再发生变化时,表明反应A(g)+2B(g)![]() C(g)+D(g)已达到平衡状态
C(g)+D(g)已达到平衡状态
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度
④混合气体的总物质的量 ⑤混合气体的平均相对分子质量
⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积
A.①②③④⑤⑥⑦⑧ B.①③④⑤
C.①②③④⑤⑦ D.①③④⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭烧瓶中,在25 ℃时存在如下平衡:2NO2(g)![]() N2O4(g)ΔH<0,将烧瓶置于100 ℃的水中,则下列几项性质中不会改变的是( )
N2O4(g)ΔH<0,将烧瓶置于100 ℃的水中,则下列几项性质中不会改变的是( )
①颜色 ②平均相对分子质量 ③质量 ④压强 ⑤密度
A. ①和③ B. ②和④ C. ④和⑤ D. ③和⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL碘化亚铁溶液中缓慢通入标况下4.48L氯气,完全反应后,溶液中有一半的Fe2+未被氧化,则原碘化亚铁溶液的物质的量浓度是( )
A. 1.2mol/L B. 1.5mol/L C. 1.6mol/L D. 2.0mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度一定的条件下,N2(g)+ 3H2(g)![]() 2NH3(g)在密闭容器中反应并达到平衡时,混合气体的平均摩尔质量为
2NH3(g)在密闭容器中反应并达到平衡时,混合气体的平均摩尔质量为![]() ,N2与NH3的浓度均为c mol·L1。若将容器的体积压缩为原来的1/2,当达到新的平衡时,下列说法中不正确的是
,N2与NH3的浓度均为c mol·L1。若将容器的体积压缩为原来的1/2,当达到新的平衡时,下列说法中不正确的是
A.新的平衡体系中,N2的浓度小于2c mol·L1大于c mol·L1
B.新的平衡体系中,NH3的浓度小于2c mol·L1大于c mol·L1
C.新的平衡体系中,混合体的平均摩尔质量大于![]()
D.新的平衡体系中,气体密度是原平衡体系的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是( )
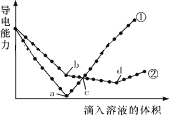
A.②代表滴加H2SO4溶液的变化曲线
B.b点溶液中大量存在的离子是SO42-、Na+、OH-
C.a、d两点对应的溶液均显中性
D.c点两溶液中含有相同量的OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com