
【题目】某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如图所示的装置。
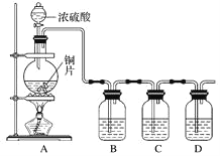
请回答下列问题:
(1)铜和浓硫酸反应的化学方程式为___。
(2)B瓶中盛有品红溶液,观察到品红溶液退色,这是因为SO2具有__(填字母,下同),C瓶中盛有新制的氯水,观察到氯水退色,这是因为SO2具有__。
A.氧化性 B.还原性 C.漂白性
(3)D瓶中盛有NaOH溶液,作用是___。
(4)充分反应后,小组同学发现铜和硫酸都有剩余。若想使剩余的铜片溶解,可再加入__(填字母)。
A.HNO3 B.NaNO3 C.Fe2O3 D.Na2CO3
【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O C B 吸收尾气,防止污染 ABC
CuSO4+SO2↑+2H2O C B 吸收尾气,防止污染 ABC
【解析】
本题的实验目的是探究SO2的漂白性和还原性。A为SO2的发生装置,B、C为探究性质装置,D为尾气处理装置。整体难度不大,根据所学知识作答即可。
(1)铜和浓硫酸反应的化学方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)B瓶中的品红溶液褪色说明SO2具有漂白性,故选C;C中新制氯水褪色,是因为Cl2和SO2发生了氧化还原反应,SO2体现了还原性,故选B;
(3)D瓶中的NaOH溶液,是用来吸收剩余的SO2,防止污染空气;
(4)铜和浓硫酸的反应,随着反应的进行,浓硫酸会变为稀硫酸,反应停止发生,故该反应中铜和硫酸都不能完全反应,反应后烧瓶中仍有铜和硫酸,则:
A、加入HNO3,剩余的铜可以和HNO3继续反应,将剩余的铜片溶解,A符合题意;
B、反应后烧瓶中仍有硫酸,加入NaNO3,相当于加入HNO3,则剩余的铜片会溶解,B符合题意;
C、加入的Fe2O3会被剩余的硫酸溶解生成Fe3+,Fe3+会和剩余的铜片反应,C符合题意;
D、加入的Na2CO3会和剩余的硫酸反应,对剩余的铜片没有影响,D不符合题意;
故选ABC。


科目:高中化学 来源: 题型:
【题目】CS2是一种常见溶剂,还可用于生产人造粘胶纤维等。回答下列问题:
(1)CS2与酸性KMnO4溶液反应,产物为CO2和硫酸盐,该反应中还原剂与氧化剂的物质的量之比为__________(MnO4-被还原为Mn2+)。
(2)甲烷硫磺法制取CS:的反应为CH4(g)+2S2(g)![]() CS2(g)+2H2S(g) △H
CS2(g)+2H2S(g) △H
①在恒温恒容密闭容器中进行该反应时,能说明该反应已达到平衡状态的是_________(填字母)。
A.v正(S2)=2v逆(CS2)
B.容器内气体的密度不再随时间变化
C.容器内气体的总压强不再随时间变化
D.单位时间内断裂C-H键数目与断裂H-S键数目相等
②已知下列键能数据:
共价键 | C-H | S=S | C=S | H-S |
键能/ | 411 | 425 | 573 | 363 |
该反应的△H=_________kJ·mol-1。
(3)在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S):n(CH4)=2:1,发生反应:CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)。0.1MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
CS2(g)+4H2(g)。0.1MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
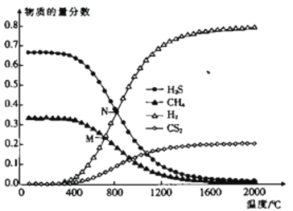
①该反应△H_________(填“>”或“<”)0。
②M点对应温度下,H2S的平衡转化率为_________,为提高H2S的平衡转化率,除改变温度外,还可采取的措施是___________________________(列举一条)。
③N点,平衡分压p(CS2)=_________MPa,对应温度下,该反应的Kp=_________(MPa)2。(Kp为以分压表示的平衡常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种常用的镇静、麻醉药物I,其合成路线如下。
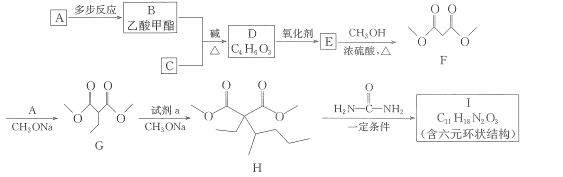
已知:①B、C互为同分异构体
②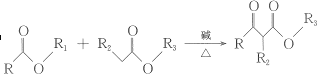 +R1OH;
+R1OH;
③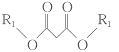 +R3Br+CH3ONa
+R3Br+CH3ONa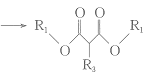 +CH3OH+NaBr;
+CH3OH+NaBr;
④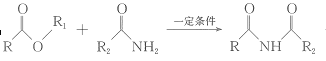 + R1OH;
+ R1OH;
其中 R、R2代表烃基或氢原子,R1、R3代表烃基。回答下列问题。
(1)试剂a为溴代物,其名称为_____,G中官能团的名称为____,G-H的反应类型为____。
(2)I的结构简式为__。
(3)写出 B+C→D的化学方程式:__________________
(4)设计实验区分B、D,所选用的试剂为___________________。
(5)已知羟基与碳碳双键直接相连的结构不稳定,同一个碳原子上连接多个羟基的结构不稳定,满足下列要求的D的所有同分异构体共有______种,写出其中互为顺反异构物质的结构简式:___________。
a.能发生银镜反应;b.能发生水解反应;c.能使Br2的CCl4溶液褪色;d.能与Na反应。
(6)参照上述合成路线,请写出以 CH2BrCH2CH2Br、CH3OH、CH3ONa 为原料(无机试剂任选),制备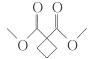 的合成路线:____________________________。
的合成路线:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型电池比传统电池有更长的循环寿命和功率密度,其工作原理如图所示。下列有关该电池的说法正确的是
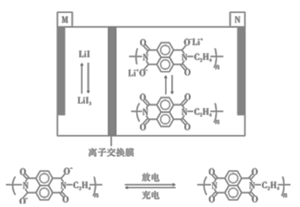
A.充电时N电极上发生氧化反应
B.放电时M极的电极反应式为3I--2e-=I3-
C.充电时Li+通过离子交换膜从M池进入N池
D.放电时每当有2 mole-转移时生成1 mol 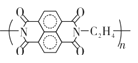
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将相同质量的镁条分别在①氧气、②空气、③氮气、④二氧化碳中完全燃烧,燃烧后所得固体产物的质量由小到大的顺序( )
A.③<②<①=④B.④=①=②=③
C.③<②<①<④D.③<①<②<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为A、B、C、D、E五种含氮物质相互转化的关系图,其中A、B、C、D常温下都是气体,B为红棕色,写出A、B、C、D、E的化学式和各步反应的化学方程式。
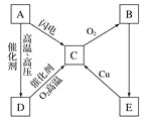
(1)各物质的化学式为
A.__,B.__,C.__,D.___,E.___。
(2)各步反应的化学方程式为
A→C:___,D→C:___,
B→E:___,E→C:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示,下列说法错误的是
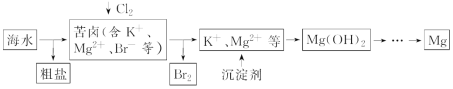
A.粗盐可采用除杂和重结晶等过程提纯
B.向苦卤中通入Cl2是为了提取溴
C.实际生产中常选用Ca(OH)2作为沉淀剂
D.工业生产中电解氯化镁溶液的方法制取镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶液中可发生反应:2FeBr2+Br2=2FeBr3,现向100mL的FeBr2溶液中通入3.36LCl2(标准状况),充分反应后测得溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为( )
A. 2molL-1 B. 1molL-1 C. 0.4molL-1 D. 0.2molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高能锂离子电池总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法正确的是
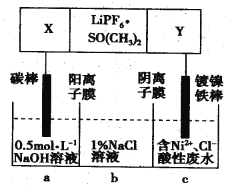
A. LiPF6·SO(CH3)2可用Li2SO4水溶液代替
B. 当转移1mol e-时,b室离子数增加NA个
C. 该电池充电时阳极反应式为Fe+Li2S-2e-=FeS+2Li+
D. 若去除图阴离子膜,则电解反应总方程式发生改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com