
【题目】一种常用的镇静、麻醉药物I,其合成路线如下。
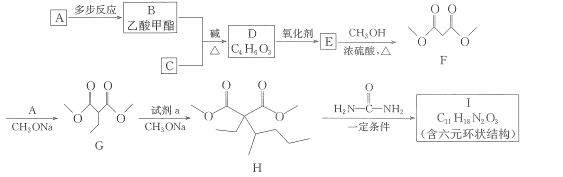
已知:①B、C互为同分异构体
②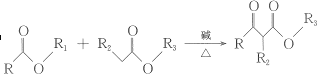 +R1OH;
+R1OH;
③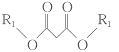 +R3Br+CH3ONa
+R3Br+CH3ONa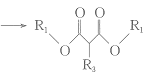 +CH3OH+NaBr;
+CH3OH+NaBr;
④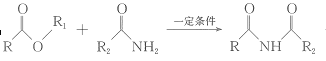 + R1OH;
+ R1OH;
其中 R、R2代表烃基或氢原子,R1、R3代表烃基。回答下列问题。
(1)试剂a为溴代物,其名称为_____,G中官能团的名称为____,G-H的反应类型为____。
(2)I的结构简式为__。
(3)写出 B+C→D的化学方程式:__________________
(4)设计实验区分B、D,所选用的试剂为___________________。
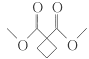
(5)已知羟基与碳碳双键直接相连的结构不稳定,同一个碳原子上连接多个羟基的结构不稳定,满足下列要求的D的所有同分异构体共有______种,写出其中互为顺反异构物质的结构简式:___________。
a.能发生银镜反应;b.能发生水解反应;c.能使Br2的CCl4溶液褪色;d.能与Na反应。
(6)参照上述合成路线,请写出以 CH2BrCH2CH2Br、CH3OH、CH3ONa 为原料(无机试剂任选),制备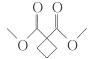 的合成路线:____________________________。
的合成路线:____________________________。
【答案】2-溴戊烷 酯基 取代反应 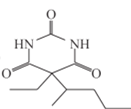
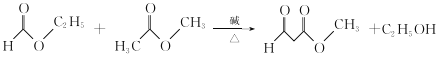 新制的Cu(OH)2浑浊液 4
新制的Cu(OH)2浑浊液 4 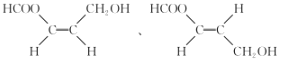 CH2BrCH2CH2Br
CH2BrCH2CH2Br![]() HOCH2CH2CH2OH
HOCH2CH2CH2OH![]()
HOOCCH2COOH ![]() CH3OOCCH2COOCH3
CH3OOCCH2COOCH3 ![]()
 。
。
【解析】
(1)对比G、H的结构,结合已知反应③发现,试剂a应为CH3CHBrCH2CH2CH3;
(2)根据信息④可知,以及I的分子式以及提示信息,H物质中的两个酯基分别与 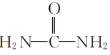 中的两个氨基反应生成具有环状结构的I物质;
中的两个氨基反应生成具有环状结构的I物质;
(3)结合转化图和信息①、②可知,推测出C物质的结构简式,然后写出 B+C→D的化学方程式;
(4)B中只含有酯基,D中含有醛基和酯基,D具有醛的性质,可以用新制的氢氧化铜悬浊液区分;
(5)根据条件,D的同分异构体中应含有甲酸酯基结构、碳碳双键和羟基等官能团,结合已知条件,写出符合限制条件的D的同分异构体;
(6)根据逆合成推导法并结合题中信息可知,获得的最终产物应是CH3OOCH2COOCH3与CH2BrCH2CH2Br反应生成的,而要得到CH3OOCH2COOCH3,必须获得HOOCCH2COOH,再从原料卤代烃经水解的醇,醇经氧化的酸,即可完成合成路线。
(1)对比G、H的结构,结合已知反应③发现,试剂a应为CH3CHBrCH2CH2CH3,即2-溴戊烷;观察G的结构,含有两个酯基,观察G→H的变化,应是2-戊基取代G中的氢原子;故G-H的反应类型为取代反应;
(2)根据信息④可知,H物质中的两个酯基分别与 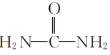 中的两个氨基反应生成具有环状结构的I物质
中的两个氨基反应生成具有环状结构的I物质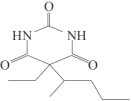 ;
;
(3)结合转化图和信息①、②可知,C物质应为甲酸乙酯,B+C-D的化学方程式: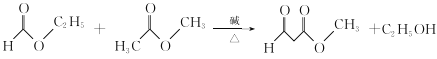 ;
;
(4)B中只含有酯基,D中含有醛基和酯基,故区分二者的试剂为新制的Cu(OH)2悬浊液(或银氨溶液)
(5)根据条件,D的同分异构体中应含有甲酸酯基结构、碳碳双键和羟基等官能团,结合已知条件,符合条件的结构应该有如下几种:![]() 、
、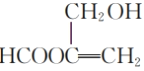 、
、 (顺式结构)、
(顺式结构)、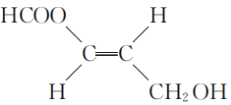 (反式结构);
(反式结构);
(6)根据逆合成推导法并结合题中信息可知,获得的最终产物应是CH3OOCH2COOCH3与CH2BrCH2CH2Br反应生成的,而要得到CH3OOCH2COOCH3,必须获得HOOCCH2COOH,再从原料卤代烃经水解的醇,醇经氧化的酸,即可完成合成路线。其合成路线图为:
CH2BrCH2CH2Br![]() HOCH2CH2CH2OH
HOCH2CH2CH2OH![]() HOOCCH2COOH
HOOCCH2COOH ![]() CH3OOCCH2COOCH3
CH3OOCCH2COOCH3 ![]()
 。
。


科目:高中化学 来源: 题型:
【题目】在一定温度下,CO和水蒸气分别为1 mol、3 mol,在密闭容器中发生反应CO+H2O(g)![]() CO2+H2,达平衡后测得CO2为0.75 mol,再通入6 mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和可能为
CO2+H2,达平衡后测得CO2为0.75 mol,再通入6 mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和可能为
A. 1.2 mol B. 1.8 mol C. 2.5 mol D. 1.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知2P4+9KOH+3H2O═3K3PO4+5PH3反应中氧化剂是______; 氧化剂与还原剂物质的量之比是_________;氧化产物是____________。
(2)请用双线桥法标出下列反应电子转移的方向和数目10Al+6NaNO3 +4NaOH═10NaAlO2 +3N2↑+2H2O______________________
(3)Mn2+、Bi3+、BiO3﹣、MnO4﹣、H+、H2O组成的一个氧化还原系统中,发生BiO3﹣→Bi3+的反应过程,据此回答下列问题 ①该氧化还原反应中,被还原的元素是____________。
②请将氧化剂、还原剂的化学式及配平后的方程式填入下列相应的位置中,并用单线桥法标出电子转移的方向和数目_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的化合物在生产、生活中有着重要的作用。
(1)已知:2CO(g)+O2(g)![]() 2CO2(g) △H1=-566kJ·molˉ1
2CO2(g) △H1=-566kJ·molˉ1
H2O(g)+CO(g)![]() H2(g)+CO2(g) △H2=-41kJ·molˉ1
H2(g)+CO2(g) △H2=-41kJ·molˉ1
CO(g)+2H2(g)![]() CH3OH(g) △H3=-107kJ·molˉ1
CH3OH(g) △H3=-107kJ·molˉ1
则CH3OH(g)+![]() O2(g)
O2(g) ![]() CO2(g)+2H2O(g) △H=___kJ·molˉ1
CO2(g)+2H2O(g) △H=___kJ·molˉ1
(2)T℃时,向容积均为2L的A、B两个密闭容器中均通入4.0molCO2和6.8molH2,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-50kJ·molˉ1。A容器中的反应在恒温、恒容条件下进行;B容器中的反应在恒温、恒压条件下进行,测得A容器中CO2的转化率 α (CO2) 随时间的变化如图所示。
CH3OH(g)+H2O(g) △H=-50kJ·molˉ1。A容器中的反应在恒温、恒容条件下进行;B容器中的反应在恒温、恒压条件下进行,测得A容器中CO2的转化率 α (CO2) 随时间的变化如图所示。

①在0~5min内A容器中v(CH3OH)=___;该温度下上述反应的平衡常数K=___(保留两位有效数字)。
②反应开始至平衡的过程中,A、B两容器中CO2的消耗速率的大小关系为v(A)___(填“>”“<”或“=”)v(B)。
③反应过程中,下列各项指标能表明A容器中反应的v正>v逆的是___(填标号)
a.体系内的压强增大
b.气体的平均相对分子质量增大
c.断裂H-H键的数目是形成C-O键数目的2倍
d.v逆(CO2)=v正(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g),下列叙述错误的是
CH3CH2OH(g)+3H2O(g),下列叙述错误的是
A. 反应需在300 ℃进行可推测该反应是吸热反应
B. 使用催化剂可提高反应速率
C. 充入大量CO2气体可提高H2的转化率
D. 从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯水中含有多种成分,因而具有多种性质,根据氯水分别与右图中四种物质发生的反应 (a、b、c、d重合部分代表物质间可反应,且氯水足量)。能证明氯水具有漂白性的是( )

A.aB.bC.cD.d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室用二氧化锰与浓盐酸制备氯气的实验装置,根据下图填空:
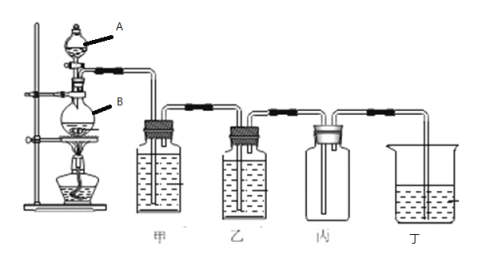
(1)仪器A的名称叫_______,仪器B的名称叫_______;
(2)写出用二氧化锰与浓盐酸制备氯气的离子方程式______;
(3)甲中盛有______,作用是_______;
(4)乙中盛有______,作用是_____;
(5)丙的作用是____,实验完成后丙中的现象是________;
(6)若丁中盛有NaOH溶液,写出发生反应的离子方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如图所示的装置。
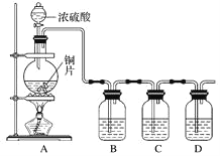
请回答下列问题:
(1)铜和浓硫酸反应的化学方程式为___。
(2)B瓶中盛有品红溶液,观察到品红溶液退色,这是因为SO2具有__(填字母,下同),C瓶中盛有新制的氯水,观察到氯水退色,这是因为SO2具有__。
A.氧化性 B.还原性 C.漂白性
(3)D瓶中盛有NaOH溶液,作用是___。
(4)充分反应后,小组同学发现铜和硫酸都有剩余。若想使剩余的铜片溶解,可再加入__(填字母)。
A.HNO3 B.NaNO3 C.Fe2O3 D.Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体,图1表示各物质浓度随时间的变化,图2表示速率随时间的变化。t2、t3、t4、t5时刻后各改变一种条件,且改变条件均不同。若t4时刻改变条件是压强,则下列说法错误的是
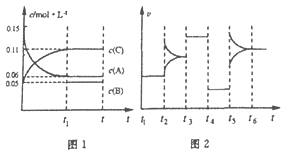
A. 若t1=15s,则前15s的平均反应速率v(C)=0.004mol·L-1·s-1
B. 该反应的化学方程式为:3A(g) ![]() B(g)+2C(g)
B(g)+2C(g)
C. t2、t3、t5时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度
D. B的起始物质的量为0.04mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com