
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
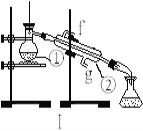
(1)写出下列仪器的名称:①__________;②_________ 。
(2)若利用装置I制取蒸馏水,将仪器补充完整后进行实验,冷却水从____________口进。(填g或f)
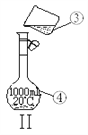
(3)现需配制250 mL 0.2 mol·L—1 NaCl溶液,其中装置II是某同学配制此溶液时转移操作的示意图,图中有两处错误,一处是未用玻璃棒引流,另一处是_________________ 。
(4)在配制过程中,其他操作都是正确的,下列情况对所配制的NaCl溶液的浓度偏低有______。
A.没有洗涤烧杯和玻璃棒 B.容量瓶不干燥,含有少量蒸馏水 C.定容时俯视刻度线 D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线。
【答案】 蒸馏烧瓶 冷凝管 g 容量瓶的规格应为250ml AD
【解析】(1)蒸馏装置中的主要仪器有蒸馏烧瓶、冷凝管、牛角管、锥形瓶,酒精灯,①为蒸馏烧瓶②为冷凝管;(2)制取蒸馏水的实质是蒸馏过程,必须用酒精灯,冷凝管下口是进水口,上口是出水口,即冷却水从g口进;(3)配制一定物质的量浓度的溶液是必须用玻璃棒引流,防止液体外溅,配制溶液应选择一定规格的容量瓶,即容量瓶的规格应为250mL;(4)A、移液后要洗涤烧杯和玻璃棒,否则导致溶质损耗,结果偏低,选项A选;B、容量瓶使用时不需干燥,定容时需要加蒸馏水,故含有少量蒸馏水对配制的溶液浓度无影响,选项B不选;C、定容时应平视刻度线观察液面,俯视刻度线会导致结果偏高,选项C不选;D、定容后经振荡、摇匀、静置,液面低于刻度线属于正常结果,若加水相当于将溶液稀释,浓度偏低,选项D选;答案选AD。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:
【题目】下列溶液中加入足量Na2O2后,仍能大量共存的一组离子是( )
A.K+、AlO2﹣、Cl﹣、SO42﹣
B.Fe2+、HCO3﹣、K2、SO42﹣
C.Na+、Cl﹣、AlO2﹣、NO3﹣
D.NH4+、NO3﹣、I﹣、CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产生活中广泛存在.
(1)①氯胺(NH2Cl)的电子式为 . 可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H= .
化学键 | 键能/(kJmol﹣1) |
N﹣H | 391.3 |
Cl﹣Cl | 243.0 |
N﹣Cl | 191.2 |
H﹣Cl | 431.8 |
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为 .
(2)用焦炭还原NO的反应为:2NO(g)+C(s)N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为(填“放热”或“吸热”)反应.
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)= .
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)N2(g)+2CO2(g),在恒温条件下,1mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示: 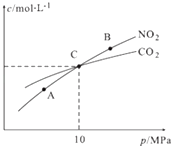
② A,B两点的浓度平衡常数关系:Kc(A)Kc(B)(填“<”或“>”或“=”).
②A,B,C三点中NO2的转化率最高的是(填“A”或“B”或“C”)点.
③计算C点时该反应的压强平衡常数Kp(C)=(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋(Bi)在医药方面有重要应用.下列关于 ![]() Bi和
Bi和 ![]() Bi的说法正确的是( )
Bi的说法正确的是( )
A.![]() Bi和
Bi和 ![]() Bi都含有83个中子
Bi都含有83个中子
B.![]() Bi和
Bi和 ![]() Bi互为同位素
Bi互为同位素
C.![]() Bi和
Bi和 ![]() Bi的核外电子数不同
Bi的核外电子数不同
D.![]() Bi和
Bi和 ![]() Bi分别含有126和127个质子
Bi分别含有126和127个质子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按如图所示的装置进行电解实验.下列说法正确的是( ) 
A.电解过程中,铜电极上有H2产生
B.电解过程中,铜电极不断溶解
C.电解过程中,石墨电极上始终有铜析出
D.整个电解过程中,H+的浓度不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只可能含有下列离子中的几种:K+、NO![]() 、SO
、SO![]() 、NH
、NH![]() 、CO
、CO![]() (不考虑溶液中少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
(不考虑溶液中少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL;
实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g。
下列说法正确的是
A. 该溶液中可能含K+
B. 该溶液中肯定含有NO![]() 、SO
、SO![]() 、NH
、NH![]() 、CO
、CO![]()
C. 该溶液中一定不含NO![]()
D. 该溶液中一定含K+,且c(K+)≥0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl﹣、NH4+、Mg2+、CO32﹣、Ba2+、SO42﹣ . 将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行如下实验:
实验序号 | 实验内容 | 实验结果 |
1 | 加AgNO3溶液 | 有白色沉淀生成 |
2 | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
3 | 加足量BaCl2溶液,反应后进行( )、( )、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次称量读数为2.33g |
试回答下列问题:
(1)根据实验1~3判断混合物中一定不存在的离子是;
(2)写出实验3中的空格处的实验操作;
(3)根据实验对Cl﹣是否存在的判断是(填“一定存在”、“一定不存在”或“不能确定”);
(4)溶液中K+是否存在?(填“一定存在”、“一定不存在”或“不能确定”);若“一定存在”,则K+物质的量浓度的范围(若“一定不存在”或“不能确定”不填此空).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中选择的仪器正确的是:①分离汽油和氯化钠溶液 ②从含Fe3+的自来水中到蒸馏水③分离氯化钾和二氧化锰混合物 ④从氯化钠溶液中得到氯化钠晶体

A. ①-丁 ②-丙 ③-甲 ④-乙 B. ①-乙 ②-丙 ③-甲 ④-丁
C. ①-丁 ②-丙 ③-乙 ④-甲 D. ①-丙 ②-乙 ③-丁 ④-甲
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com