
【题目】工业甲醇的质量分数可以用下列方法测定:
①在稀H2SO4中甲醇被Cr2O72—氧化成CO2和H2O,
反应式为:CH3OH+Cr2O72—+8H+=CO2↑+2Cr3++6H2O;
②过量的Cr2O72—可用Fe2+与之完全反应:
___Cr2O72—+___Fe2++____H+—_____Cr3++____Fe3++____H2O
现有0.12 g工业甲醇,在H2SO4溶液中与25 mL 0.2 mol·L-1K2Cr2O7溶液反应,多余的K2Cr2O7再用1 mol·L—1FeSO4与其反应,结果用去FeSO4溶液9.6 mL。
(1)配平第②步的离子方程式。
(2)计算工业甲醇的质量分数_______________。
【答案】1 6 14 2 6 7 由反应②可知,反应①剩余的n(Cr2O72-)=![]() n(Fe2+)=0.0016mol
n(Fe2+)=0.0016mol
反应①消耗的n(Cr2O72-)=0.0050mol-0.0016mol=0.0034mol
则:n(CH3OH)=0.0034mol
w(CH3OH)=![]()
【解析】
(1)依据化学反应的元素化合价变化结合电子守恒、电荷守恒、原子守恒计算配平离子方程式;
(2)依据化学方程式的定量计算分析,依据FeSO4的消耗量,计算出多余的K2Cr2O7,计算与甲醇反应的K2Cr2O;结合化学方程式进行计算:CH3OH+Cr2O72-+8H+=CO2↑+2Cr3++6H2O。
(1)依据化学反应的元素化合价变化结合电子守恒计算配平离子方程式,电子转移:Cr2O72-~2Cr3++~6e-;6Fe2+~6Fe3+~6e-;所以配平氧化还原反应的电子守恒,结合电荷守恒和原子守恒得到配平系数:1、6、14、2、6、7;离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;故答案为:1、6、14、2、6、7;
(2)由反应②可知,反应①剩余的n(Cr2O72-)=![]() n(Fe2+)=0.0016mol
n(Fe2+)=0.0016mol
反应①消耗的n(Cr2O72-)=0.0050mol-0.0016mol=0.0034mol
则:n(CH3OH)=0.0034mol
w(CH3OH)=![]() ,故答案为:90.7%。
,故答案为:90.7%。


科目:高中化学 来源: 题型:
【题目】碳氢化合物有多种,它们在工业生产、生活中有重要用途。
(1)石油危机日渐严重,甲烷的转化和利用在天然气化工行业有非常重要的作用。甲烷重整技术主要是利用甲烷和其他原料来制备合成气(CO和H2混合气体)。现在常见的重整技术有甲烷-水蒸气重整,其反应为:CH4(g) + H2O(g) ![]() CO(g) + 3H2(g) ΔH>0
CO(g) + 3H2(g) ΔH>0
如图为反应压强为0.3 MPa,投料比n(H2O)/n(CH4)为1,在三种不同催化剂催化作用下,甲烷-水蒸气重整反应中CH4转化率随温度变化的关系。
下列说法正确的是________。
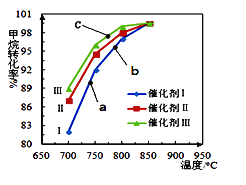
A.在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是Ⅰ>Ⅱ>Ⅲ
B.b点CH4的转化率高于a点,原因是b、a两点均未达到平衡状态,b点温度高,反应速率较快,故CH4的转化率较大
C.C点一定未达到平衡状态
D.催化剂只改变反应速率不改变平衡移动,所以在850℃时,不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下达平衡时CH4的转化率相同
(2) 乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,甲烷在1500℃左右气相裂解法生产,裂解反应:2CH4(g)=C2H2(g)+3H2(g)的△H= +376.4kJ/mol。
哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。
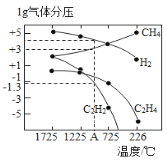
①T1℃时,向1L恒容密闭容器中充入0.3 mol CH4只发生反应2CH4(g) ![]() C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H____0(填“>”或“<”),CH4的平衡转化率为____%(保留3位有效数字)。上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1_____(填“>”或“<”)T2,t=______s。
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H____0(填“>”或“<”),CH4的平衡转化率为____%(保留3位有效数字)。上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1_____(填“>”或“<”)T2,t=______s。
②由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25°C时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11,下列说法正确的是
A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
C.25°C时,Mg(OH)2固体在20mL 0.01 mol/L氨水中的Ksp比在20mL 0.01mol/L NH4Cl溶液中的Ksp小
D.25°C时,在Mg(OH)2的悬浊液加入浓NaF溶液后,Mg(OH)2不可能转化成为MgF2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果酸的结构简式为HOOC![]() CH2—COOH,下列说法正确的是
CH2—COOH,下列说法正确的是
A. 苹果酸中能发生酯化反应的官能团有2种
B. 1mol苹果酸可与3mol NaOH发生中和反应
C. 1mol苹果酸与足量金属Na反应生成生成1mol H2
D. HOOC—CH2—CH(OH)—COOH与苹果酸互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.1g镁铝合金溶于600mL0.5mol·L-1H2SO4溶液中,完全溶解后再加入1.0mol·L-1的NaOH溶液,得到沉淀的质量为13.6g,继续滴加NaOH溶液时则沉淀会减少。
(1)当加入__mLNaOH溶液时,可使溶解在硫酸中的Mg![]() 和Al
和Al![]() 恰好完全沉淀。
恰好完全沉淀。
(2)计算合金溶于硫酸时所产生的氢气在标准状况下的体积。(列出算式)___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于![]() 的说法正确的是
的说法正确的是
A. 所有原子可能都在同一平面上 B. 最多只可能有9个碳原子在同一平面
C. 有7个碳原子可能在同一直线 D. 只可能有5个碳原子在同一直线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有CH4、C2H4、C2H6三种有机化合物:
(1)等质量的以上物质完全燃烧时耗去O2的量最多的是__________。
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是__________。
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是__________,生成水最多的是__________。
(4)在120℃、1.01×105Pa时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下3个热化学方程式:
H2(g)+![]() O2(g)=H2O(g) ΔH1= -a kJ·mol-1①
O2(g)=H2O(g) ΔH1= -a kJ·mol-1①
H2(g)+![]() O2(g)=H2O(l) ΔH2= -b kJ·mol-1②
O2(g)=H2O(l) ΔH2= -b kJ·mol-1②
2H2(g)+O2(g)=2H2O(l) ΔH3= -c kJ·mol-1③
则由下表所列的原因能推导出后面结论的是( )
选项 | 原因 | 结论 |
A | H2的燃烧是放热反应 | a、b、c均大于零 |
B | ①和②中物质的化学计量数均相同 | a=b |
C | ①和③中H2O的状态不同,化学计量数不同 | a、c不会有任何关系 |
D | ③的化学计量数是②的2倍 | ΔH2<ΔH3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为 ,分析其结构,并回答下列问题:
,分析其结构,并回答下列问题:
(1)写出其分子式:____________________________________________。
(2)其中含有____个不饱和碳原子,分子中有____个双键。
(3)分子中的极性键有__________(写出2种即可)。
(4)分子中的饱和碳原子有______个,一定与苯环处于同一平面的碳原子有______个。
(5)分子中C—C===O键角约为__________,H—C≡C键角约为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com