
【题目】在![]() 反应中,表示该反应速率最快的是
反应中,表示该反应速率最快的是
A.v(A)= 0.5 mol/(L·s)B.v(B)= 0.3 mol/(L·s)
C.v(C)= 0.8 mol/(L·s)D.v(D)= 1.8 mol/(L·min)
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得诺贝尔化学奖。轮烷是一种分子机器的“轮子”,芳香化合物a、b、c是合成轮烷的三种原料,其结构如下图所示。下列说法不正确的是

A. b、c互为同分异构体
B. a、c分子中所有碳原子均有可能处于同一平面上
C. a、b、c均能发生氧化反应、加成反应、加聚反应和酯化反应
D. a、b、c均能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应:![]() 。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4
。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4![]() 、0.2
、0.2![]() 、0.4
、0.4![]() ,当反应达到平衡时,可能存在的数据是( )
,当反应达到平衡时,可能存在的数据是( )
A. SO2的浓度为0.8![]() ,O2为0.4
,O2为0.4![]() B. SO2的浓度为0.5
B. SO2的浓度为0.5![]()
C. SO3的浓度为0.8![]() D. SO2、SO3的浓度一定均为0.3
D. SO2、SO3的浓度一定均为0.3![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸银是一种无色晶体,易溶于水。用于照相乳剂、镀银、制镜、印刷、医药、染毛发等,也用于电子工业。硝酸银不稳定,易发生如下反应:
①2AgNO3(s)=2Ag(s)+ 2NO2(g)+O2(g) △H1>0
②2NO2(g) ![]() N2O4(g) △H2<0
N2O4(g) △H2<0
(1)实验室配制硝酸银溶液的方法是:将一定量硝酸银固体溶于浓硝酸中,加水稀释至指定体积。“硝酸”的作用是___________________。
(2)2AgNO3(s) =2Ag(s)+N2O4(g)+O2(g) △H=______________ (用含△H1、△H2的式子表示)。
(3)温度T1时,在0.5L的恒容密闭容器中投入3.4 g AgNO3(s)并完全分解测得混合气体的总物质的量(n)与时间(t)的关系如图所示。
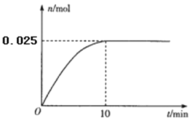
①下列情况能说明体系达到平衡状态的是_________(填字母)
a.固体质量不再改变 b.O2的浓度不再改变
c.NO2的体积分数不再改变 d.混合气体的密度不再改变
②若达到平衡时,混合气体的总压强p=0. 3MPa。反应开始到
10min内N2O4的平均反应速率为___________ MPa·min-1。在该温度下2NO2(g)![]() N2O4(g)的平衡常数Kp=___________(MPa)-1(结果保留2位小数)。
N2O4(g)的平衡常数Kp=___________(MPa)-1(结果保留2位小数)。
[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数(Kp),组分的分压(P1) =平衡时总压(p)×该组分的体积分数(![]() )]
)]
③实验测得:υ正=υ(NO2)消耗=k正c2(NO2),υ逆=2υ(N2O4) 消耗=k逆c(N2O4),k正、k逆为速率常数只受温度影响。则化学平衡常数K与速率常数k正、k逆的数学关系是K=___________。若将容器的温度改变为T2时其k正=k逆,则T1______T2(填“>”、“<”或“=")
(4)NO与O2反应生成NO2的反应历程为:第一步NO+NO![]() N2O2 (快速平衡)
N2O2 (快速平衡)
第二步N2O2+O2=2NO2 (慢反应),下列叙述正确的是___________(填标号)。
A. υ(第一步的正反应) <υ(第二步的反应) B.总反应快慢由第二步决定
C. 第二步的活化能比第一步的高 D.第二步中N2O2与O2的碰撞100%有效
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述正确的是
A.乙醇是良好的有机溶剂, 75 % 的酒精还可以灭活新冠病毒
B.苯酚有毒,沾到皮肤上可用 65 ℃的以上热水洗涤
C.乙烯、聚氯乙烯和苯分子中碳原子的杂化方式相同
D.有机物![]() 的名称是2-甲基-2-丁烯
的名称是2-甲基-2-丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置检验乙烯时不需要除杂的是( )
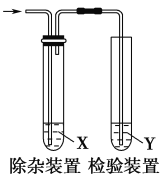
选项 | 乙烯的制备 | 试剂X | 试剂Y |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | 溴水 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
①晶体中分子间作用力越大, 分子越稳定
②原子晶体中共价键越强, 熔点越高
③干冰是 CO2 分子通过氢键和分子间作用力有规则排列成的分子晶体
④在Na2O和Na2O2晶体中,阴、阳离子数之比相等
⑤正四面体构型的分子,键角都是109°28',其晶体类型可能是原子晶体或分子晶体
⑥分子晶体中都含有化学键
⑦含4.8 g碳元素的金刚石晶体中的碳碳键的物质的量为0.8 mol
A.①②③④⑤B.②④⑦C.⑤⑥⑦D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论正确的是( )

A.反应进行的前3min内,用X表示的反应速率v(X)=0.3mol/(L·min)
B.容器中发生的反应可表示为:3X(g)+Y(g)2Z(g)
C.保持其他条件不变,升高温度,反应的化学平衡常数K增大
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZnO在医药、石化等领域有广泛的用途。研究小组用某闪锌矿(主要成分ZnS,含有FeS、SiO2、MnCO3等杂质)制备氧化锌和硫单质,设计如下流程:

请回答下列问题:
(1)滤渣1的化学式为_______,任写一种该物质的用途:_______________。
(2)沉淀X的化学式为______________。
(3)“转化Ⅱ”中主要反应的离子方程式为___________________________。
(4)若Ksp(ZnCO3)=1.5×10﹣10,溶液中离子浓度≤1.0×10﹣5molL﹣1时,认为该离子沉淀完全。则欲使1Lc(Zn2+)=1.5molL﹣1溶液中Zn2+沉淀完全,需加入等体积的Na2CO3溶液的物质的量浓度至少为_______________________molL﹣1 (写出精确计算结果,溶液混合时体积变化忽略不计)。
(5)“一系列操作”包括过滤、洗涤、干燥。过滤所用的玻璃仪器有______;洗涤沉淀的操作为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com