
【题目】科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导正极生成的O2-(O2+4e-=2O2-)。
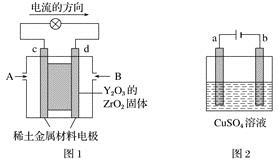
(1)c电极的名称为___,d电极上的电极反应式为___。
(2)如图2所示用石墨电极电解100mL0.5mol·L-1CuSO4溶液,a电极上的电极反应式为___。
(3)若a电极产生56mL(标准状况)气体,则所得溶液中的c(H+)=___(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入___(填字母)。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
【答案】正极 CH4+4O2--8e-=CO2+2H2O 4OH--4e-=2H2O+O2↑(2H2O-4e-= O2↑+4H+) 0.1mol·L-1 ac
【解析】
图1是原电池,依据电流流向是从正极经外电路流向负极可知,c为正极,d为负极;
图2有外接电源,为电解池装置,a与电源正极相连,为阳极,b为阴极,据此分析回答。
(1)由分析可知,图1中c为正极,d为负极,燃料电池中,燃料在负极失电子,被氧化,结合电解质、电荷守恒、原子守恒可得:负极电极反应为:CH4+4O2--8e-=CO2+2H2O,故答案为:正极;CH4+4O2--8e-=CO2+2H2O;![]() 由上面分析可知,图2中:a电极为电解池中的阳极,因为是惰性电极,所以溶液中水电离的氢氧根离子在阳极失电子,被氧化,发生的电极反应为4OH--4e-=2H2O+O2↑(2H2O-4e-= O2↑+4H+),故答案为:4OH--4e-=2H2O+O2↑(2H2O-4e-= O2↑+4H+);
由上面分析可知,图2中:a电极为电解池中的阳极,因为是惰性电极,所以溶液中水电离的氢氧根离子在阳极失电子,被氧化,发生的电极反应为4OH--4e-=2H2O+O2↑(2H2O-4e-= O2↑+4H+),故答案为:4OH--4e-=2H2O+O2↑(2H2O-4e-= O2↑+4H+);
(3) 由4OH--4e-=2H2O+O2↑可知,当产生1mol氧气时,消耗4molOH-,同时产生4molH+,本题中:a电极产生![]() 标准状况
标准状况![]() 氧气,物质的量为
氧气,物质的量为![]() ,消耗氢氧根离子物质的量为0.0025mol×4=0.01mol,故溶液中生成氢离子物质的量为
,消耗氢氧根离子物质的量为0.0025mol×4=0.01mol,故溶液中生成氢离子物质的量为![]() ,则c(H+)
,则c(H+)![]() 0.1mol·L-1。阴极,也就是b极,发生的反应为:Cu2++2e-=Cu,所以电解总反应为:
0.1mol·L-1。阴极,也就是b极,发生的反应为:Cu2++2e-=Cu,所以电解总反应为:![]() ,由总反应可知:电解
,由总反应可知:电解![]() 溶液的过程中,每损失2个Cu原子,就损失2个 O原子,相当于损失一个CuO,为了使
溶液的过程中,每损失2个Cu原子,就损失2个 O原子,相当于损失一个CuO,为了使![]() 溶液,恢复原浓度,应加入:
溶液,恢复原浓度,应加入:
a.损失CuO,加入一定的CuO可以恢复原状,a正确;
b.Cu(OH)2加进去比CuO多了1个H2O,b错误;
c.CuCO3看似多了CO2,但实际上加入后CuCO3和电解产生的硫酸反应生成CO2逸到空气中去了,相当于CuO,c正确;
d.和b同理,多了H2O,d错误;
综上所述:ac正确。
故答案为:1mol·L-1;ac。


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】镁是一种银白色的碱土金属,镁元素在地壳中的含量约为2.00%,位居第八位,镁及其化合物在研究和生产中具有广泛用途。请回答下列问题:
(1)在室温下,纯净的氮化镁(Mg3N2)为黄绿色的粉末,能与水反应,常用作触媒,实验室用如图1所示装置和药品制备少量氮化镁。
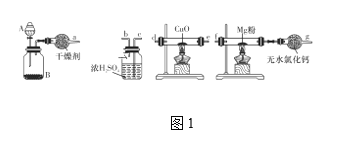
①A中盛装的是____,B中可盛装碱石灰,二者混合可制取氨气。
②按照气流的方向从左至右连接装置:a接____、____接____、_b__接____。
③气体通过CuO这一装置的目的是什么?用化学方程式回答:______。
④无水氯化钙装置可防止外界空气中的水进入,以防_____________(化学方程式表示)的发生。
(2)碳酸镁可用作耐火材料、锅炉和管道的保温材料,以及食品、药品、化妆品、橡胶、墨水等的添加剂。
Ⅰ.合成碳酸镁晶体的步骤如下:
步骤1:配制0.5 mol·L-1MgSO4溶液和0.5 mol·L-1NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL四口烧瓶中,开启搅拌器,温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完毕,然后用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤,洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得到产品碳酸镁晶体(MgCO3·nH2O,n=1~5)。
①配制0.5 mol·L-1MgSO4溶液500 mL,需要的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、____。
②步骤3中加氨水后发生反应的离子方程式为________________
Ⅱ.测定合成的MgCO3·nH2O中的n值。
称量1.000 g碳酸镁晶体,放入图2所示的广口瓶中,加入适量水,滴入稀硫酸与晶体反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,后期将温度升到30 ℃,最后烧杯中的溶液用已知浓度的盐酸滴定,测得生成CO2的总量;重复上述操作2次。

③上述反应后期要升温到30 ℃,主要目的是_____________________
④若实验测得1.000 g碳酸镁晶体产生CO2的平均物质的量为a mol,则n为__________(用含a的表达式表示)。
⑤若称取100 g上述晶体进行热重分析,得到的热重曲线如图3所示,则合成的晶体中n=____(取整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、S 的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)CO2 的重整用 CO2 和 H2 为原料可得到 CH4 燃料。
已知: ①CH4 (g)+CO2(g)=2CO(g)+2H2(g) △H1=+247kJ/mol
②CH4 (g)+H2O(g)=CO(g)+3H2(g) △H2=+205kJ/mol
写出 CO2 重整的热化学方程式:_____。
(2) “亚碳酸盐法”吸收烟中的 SO2
①将烟气通入 1.0mol/L 的 Na2SO3 溶液,若此过程中溶液体积不变,则溶液的 pH 不断_____(填“减小”“不变” 或“增大)。当溶液 pH 约为 6 时,吸收 SO2 的能力显著下降,应更换吸收剂,此时溶液中 c(SO32-) =0.2mol/L, 则溶液中 c(HSO3-) =_____。
②室温条件下,将烟气通入(NH4)2SO3 溶液中,测得溶液 pH 与各组分物质的量分数的变化关系如图: b 点时溶液 pH=7,则 n(NH4+):n(HSO3—)= ______________ 。

(3)催化氧化法去除 NO。一定条件下,用 NH3 消除 NO 污染,其反应原理4NH3+6NO![]() 5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为 4:1、3:1、1:3 时,得到 NO 脱除率曲线如图所示:
5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为 4:1、3:1、1:3 时,得到 NO 脱除率曲线如图所示:

①曲线 a 中,NO 的起始浓度为6×10-4mg·m-3,从 A 点到 B 点经过0.8s,该时间段内 NO 的脱除速率为_____mg·m-3·s-1。
②曲线 b 对应 NH3 与 NO 的物质的量之比是_____。
(4)间接电化学法除 NO。其原理如图所示:写出阴极的电极反应式(阴极室溶液呈酸性)_____。吸收池中除去 NO 的原理_____(用离子方程式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2(黄绿色易溶于水的气体)是一种高效、低毒的消毒剂。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收和释放进行了研究。
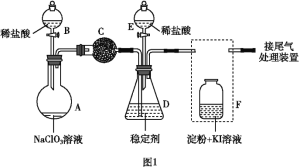
(1)仪器A的名称是_______________________。
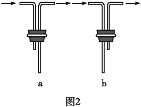
(2)安装F中导管时,应选用图2中的___________________。
(3)A中发生反应生成ClO2和Cl2,其氧化产物和还原产物物质的量之比为__________。
(4)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是__________________。
(5)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为____。
(6)ClO2很不稳定,需随用随制,产物用水吸收可得到ClO2溶液。为测定所得溶液中ClO2的浓度,进行了下列实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成100.00mL试样,量取V0 mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用c mol·L1 Na2S2O3溶液滴定至终点。重复2次,测得消耗Na2S2O3溶液平均值为V1 mL。
(已知2ClO2+10I+8H+=2Cl+5I2+4H2O 2Na2S2O3+I2![]() Na2S4O6+2NaI)
Na2S4O6+2NaI)
计算该ClO2的浓度为______g/L(用含字母的代数式表示,计算结果化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烷催化裂化时碳链按两种方式断裂,生成两种烷烃和两种烯烃。如果丁烷的裂化率为60%,且裂化生成的两种烯烃物质的量相等,则裂化后得到的含氢质量分数最高的气体占混合气体的体积分数为
A. 18.75% B. 30% C. 15% D. 22.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时将10mLpH=11的氨水加水稀释至100mL,下列判断正确的是
A.稀释后溶液的pH=7B.氨水的电离度增大,溶液中所有离子的浓度均减小
C.稀释过程中![]() 增大D.pH = 11氨水的浓度为0.001mol/L
增大D.pH = 11氨水的浓度为0.001mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中A、B、C、D、E、F、G均为有机化合物。根据如图所示转化关系回答下列问题:
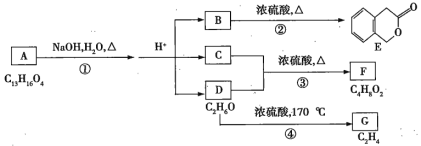
(1)D的化学名称是___________________。
(2)反应③的化学方程式是______________________________________________________。
(3)B的分子式是_________,A的结构简式是_________。反应①的反应类型是_________。
(4)符合下列两个条件的B的同分异构体(不包括B)有_________种。
①与B有相同官能团且苯环上只有两个取代基 ②不与![]() 溶液发生显色反应
溶液发生显色反应
写出其中任意一种同分异构体的结构简式:_______________。
(5)反应④的化学方程式是_________________________________________________________________。G是重要的工业原料,用化学方程式表示G形成高聚物的反应:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锂(Li2O)是离子晶体,其晶格能可以通过图所示循环进行计算。下列说法错误的是
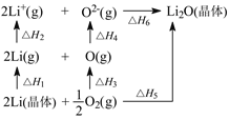
A.O=O键键能为ΔH3
B.Li原子的第一电离能为0.5ΔH2
C.Li2O的晶格能为ΔH6取正值
D.ΔH1+ΔH2+ΔH3+ΔH4+ΔH6=ΔH5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com