
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
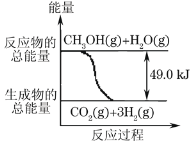
①CH3OH(g)+H2O(g)→CO2(g)+3H2(g) -49.0kJ
②CH3OH(g)+![]() O2(g)→CO2(g)+2H2(g)+192.9kJ
O2(g)→CO2(g)+2H2(g)+192.9kJ
下列说法正确的是( )
A.1molCH3OH完全燃烧放热192.9kJ
B.反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+![]() O2(g)→CO2(g)+2H2(g)+Q的Q<192.9kJ
O2(g)→CO2(g)+2H2(g)+Q的Q<192.9kJ
【答案】D
【解析】
A.燃烧热是1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,即H元素要转化为液态水而不是转化为氢气,故1molCH3OH完全燃烧放出的热量不是192.9kJ,故A错误;
B.因为①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)的Q小于0,该反应是吸热反应,所以反应物的总能量应该小于生成物的总能量,故B错误;
C.②中的热化学方程式表明,CH3OH转变成H2的过程不一定要吸收能量,故C错误;
D.因为CH3OH(l)变成CH3OH(g)需要吸收能量,根据②推知反应:CH3OH(l)+![]() O2(g)→CO2(g)+2H2(g)+Q的Q<192.9kJ,故D正确;
O2(g)→CO2(g)+2H2(g)+Q的Q<192.9kJ,故D正确;
故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向一支充满水倒立于水槽中的大试管里依次通入a毫升二氧化氮,b毫升一氧化氮,c毫升氧气后,最终仍为一试管液体,则a、b、c之比可能为
A.6:2:3B.5:1:2C.6:1:2D.5:2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备乙酸乙酯的绿色合成路线之一为:
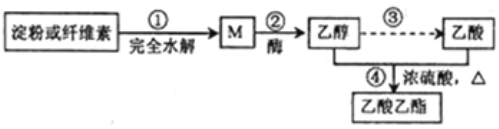
下列说法不正确的是( )
A. 加热条件下,M能与新制氢氧化铜悬浊液发生反应
B. ④的反应类型属于酯化反应,也属于取代反应
C. 淀粉和纤维素的化学式均为(C6H10O5)n,二者互为同分异构体
D. 用饱和碳酸钠溶液可以鉴别乙醇、乙酸和乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的热化学方程式。
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH=+64.39kJ/mol
2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.46kJ/mol
H2(g)+![]() O2(g)=H2O(l) ΔH=-285.84kJ/mol
O2(g)=H2O(l) ΔH=-285.84kJ/mol
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为_____________。
(2)在298K下,C、Al的单质各1mol完全燃烧,分别放出热量akJ和bkJ。又知一定条件下,Al能将C从CO2置换出来,写出此置换反应的热化学方程式_________________
(3)25℃,1.01×105Pa下,1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出表示硫燃烧热的热化学方程式___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)气态烃D是石油裂解产品之一,标准状况下D的密度为1.25 g·L-1,根据下列转化关系推断:
A![]() B
B![]() C、A
C、A![]() D
D![]() E
E
请写出A、C、E的结构简式:A________、C________、E________。
(2)写出下列反应的化学方程式:A―→B:_________________________________________;
D―→E:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 (25 |
|
|
|
下列选项错误的是( )
A.CN + H2O + CO2 → HCN +HCO3﹣
B.2HCOOH + CO32﹣ → 2HCOO + H2O + CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,化学家们已合成了一系列有机物:
![]()
联苯 联三苯 联四苯 联m苯
根据这一系列有机物的规律,试回答:
(1)写出联苯的化学式(用m表示)_________________
(2)该系列有机物中,其中含碳量最高的化合物碳含量百分率约为________
(保留三位有效数字)
(3)若联苯中C—C能自由旋转,那么联苯的二氯取代物有______种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关苯的叙述中,错误的是( )
A.能使酸性KMnO4溶液褪色
B.无色、有特殊气味的液体,不溶于水,密度比水的小
C.在FeBr3催化作用下,苯与液溴反应生成溴苯和溴化氢
D.50~60℃时,在浓硫酸存在下,苯与浓硝酸反应生成硝基苯和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳循环可以通过下列途径:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) ![]() +49.0kJ,在容积为2 L的密闭容器中充入1 mol CO2和3 mol H2,在两种不同的实验条件下进行反应,测得CH3OH(g)的物质的量随时间变化情况如图所示:
+49.0kJ,在容积为2 L的密闭容器中充入1 mol CO2和3 mol H2,在两种不同的实验条件下进行反应,测得CH3OH(g)的物质的量随时间变化情况如图所示:
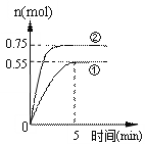
(1)前5 min内实验①的平均反应速率v(H2)=_____mol/(Lmin)。
(2)能说明上述反应达到平衡状态的是_________(填编号)。
a.混合气体的平均相对分子质量不随时间变化而变化
b.单位时间内每消耗3 mol H2,同时生成1 mol H2O
c.CO2的体积分数在混合气体中保持不变
d.v逆(CO2) =3v正(H2)
(3)与①相比,②仅改变一种反应条件,所改变的条件是____________,判断的理由_______________________________________________________。
(4)在一定温度下,把2.0 LCO2和6.0 LH2通入一个带活塞的体积可变的密闭容器中,活塞的一端与大气相通,反应达到平衡后,测得混合气体为7.0 L。若需控制平衡后混合气体为6.5 L,则可采取的措施是_____;欲使反应的K减小,可以采取的措施是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com