
【题目】向一支充满水倒立于水槽中的大试管里依次通入a毫升二氧化氮,b毫升一氧化氮,c毫升氧气后,最终仍为一试管液体,则a、b、c之比可能为
A.6:2:3B.5:1:2C.6:1:2D.5:2:3
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】工业上可用隔膜电解槽电解食盐水的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,如次氯酸钠等。根据题意完成下列计算:
(1)某氯碱厂测得某组电解槽的阳极每小时产生气体485.92m3(折算到标准状况,下同),合________________mol;测知其中Cl2的体积分数为0.985(杂质为O2),则该气体的密度为________________;阴极产生NaOH_________mol(保留四位有效数字,下同)。
(2)下表提供了两极溶液浓度的变化数据(阴阳两个极区的物料不流通,忽略其中溶液的体积变化)。
阴极:NaOH溶液质量分数 | 阳极:NaCl溶液浓度(g/L) | |
进料液 | 0.30 | 310 |
电解后 | 0.32 | 210 |
若某个电解槽每小时进NaOH溶液52.000 kg,得到碱溶液初产品90.416 kg,则阳极区每小时加入NaCl溶液_______________m3。取碱溶液初产品中的40% 加入一定量纯水,达到阴极进料液的浓度要求,则需要加入纯水_________________L。
(3)产品之一----漂水(NaClO溶液)具有良好的消毒、漂白能力。在制漂水过程中取1L溶液,测得pH=12(忽略水解),NaClO含量为0.3725g。在一定条件下,将该溶液制成晶体,质量最多为1.335g。通过列式计算,写出该晶体的化学式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了元素周期表中前20号元素中某些元素性质的一些数据:
性质元素 | 原子半径( | 最高价态 | 最低价态 |
① | 1.02 |
|
|
② | 2.27 |
| — |
③ | 0.74 | — |
|
④ | 1.43 |
| — |
⑤ | 0.77 |
|
|
⑥ | 1.10 |
|
|
⑦ | 0.99 |
|
|
⑧ | 1.86 |
| — |
⑨ | 0.75 |
|
|
⑩ | 1.17 |
|
|
试回答下列问题。
(1)以上10种元素中,第一电离能最小的是______(填序号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的物质有______(填分子式,两种即可)。元素⑨和⑩形成的化合物的化学式为______;元素①的原子价电子排布式是______。
(3)①、⑥、⑦、⑩四种元素的简单氢化物的稳定性由强到弱的顺序是______(填化学式)。
(4)③和⑨两元素相比,非金属性较弱的是______(填名称),可以验证该结论的是______(填序号)。
A.气态氢化物的挥发性
B.单质分子中的键能
C.两元素的电负性
D.含氧酸的酸性
E.最简单氢化物的稳定性
F.两单质在自然界中的存在形式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl22H2O的流程如下:
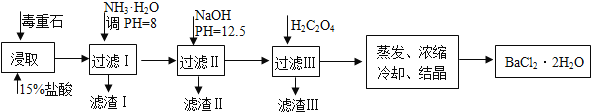
完成下列填空:
(1)毒重石用盐酸浸取前需充分研磨,目的是____________________。实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的____________________________。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)加入NH3H2O调节pH=8可除去_______(填离子符号),滤渣Ⅱ 中含__________(填化学式)。加入H2C2O4时应避免过量,原因是_________________________。
已知:Ksp(BaC2O4)=1.6×10﹣7,Ksp(CaC2O4)=2.3×10﹣9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法中正确的是
①棉花、蚕丝和人造丝的主要成分都是纤维素
②淀粉、油脂、蛋白质在一定条件下都能发生水解
③除去溴苯中的少量溴:加入NaOH溶液,振荡、静置分层后,除去水层
④除去乙酸乙酯中残留的乙酸,加过量饱和![]() 溶液振荡后,静置分液
溶液振荡后,静置分液
⑤塑料、橡胶和光导纤维都是合成高分子材料
⑥石油的分馏、裂化和煤的干馏都是化学变化
A.①⑤⑥B.①②③⑤C.②③④D.③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向等物质的量浓度的Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS—、S2—)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
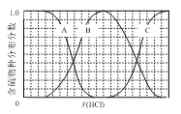
(1)含硫物种B表示__________(填离子符号)。
(2)在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为_____________(填选字母)。
a.c(Na+)= c(H2S)+c(HS—)+2c(S2—)
b.2c(Na+)=c(H2S)+c(HS—)+c(S2—)
c.c(Na+)=3[c(H2S)+c(HS—)+c(S2—)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组将纯净的SO2气体通入0.1molL﹣1的Ba(NO3)2溶液中,得到了BaSO4沉淀。为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2;
(1)验证假设一
该小组设计实验验证了假设一,请在下表空白处填写相关实验现象.
实验步骤 | 实验现象 | 结论 |
实验1:在盛有不含O2的25mL0.1molL﹣1BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | _______ | 假设一成立 |
实验2:在盛有不含O2的25mL0.1molL﹣1Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 | ________ |
为深入研究该反应,该小组还测得上述两个实验中溶液pH随通入SO2体积的变化曲线如图。实验1中溶液pH变小的原因是____________;V1时,实验2中溶液pH小于实验1的原因是__________。(用离子方程式表示)
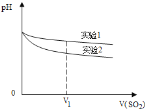
(2)验证假设二
请设计实验验证假设二,写出实验步骤、预期现象和结论:
实验步骤 | 实验现象 | 结论 |
__________________ | ______________ | 假设二成立 |
(3)若假设二成立,请预测:在相同条件下,分别用足量的O2和KNO3氧化相同的H2SO3溶液(溶液体积变化忽略不计),充分反应后两溶液的pH前者_____________(填“大于”或“小于”)后者,理由是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】形形色色的物质,构成了我们这个五彩缤纷的世界。世上万物,神奇莫测,常常超乎人们按“常理"的想象。学习物质结构和性质的知识,能使你想象的翅膀变得更加有力。
(1)基态Ga原子的核外电子排布式是[Ar]__,基态Ga原子核外电子占据最高能级的电子云轮廓图为___。
(2)HC≡CNa(乙炔钠)广泛用于有机合成,乙炔钠中C原子的杂化类型为__。乙炔钠中存在___(填字母)。
A.金属键 B.σ键 C.π键 D.氢键 E.配位键 F.离子键 G.范德华力
(3)NaN3是汽车安全气囊中的主要化学成分,其阴离子的立体构型为___。写出和该阴离子互为等电子体的一种分子的结构式___。
(4)配体中配位原子提供孤电子对的能力与元素的电负性有关,SCN-的结构式可以表示为[S=C=N]-或[S-C≡N]-,SCN-与Fe3+、Au+和Hg2+等离子能形成配离子,N、C、S的电负性依次为3.0、2.5和2.5。SCN-中提供孤电子对的原子可能是___。
(5)某离子晶体的晶胞结构如图所示。
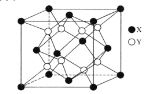
①晶体中在每个X周围与它最近且距离相等的X共有___个。
②设该晶体的摩尔质量为Mg·mol-1,晶胞的密度为ρg·cm-3,阿伏加德罗常数为NA,则晶体中两个最近的X间的距离为___cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
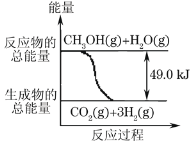
①CH3OH(g)+H2O(g)→CO2(g)+3H2(g) -49.0kJ
②CH3OH(g)+![]() O2(g)→CO2(g)+2H2(g)+192.9kJ
O2(g)→CO2(g)+2H2(g)+192.9kJ
下列说法正确的是( )
A.1molCH3OH完全燃烧放热192.9kJ
B.反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+![]() O2(g)→CO2(g)+2H2(g)+Q的Q<192.9kJ
O2(g)→CO2(g)+2H2(g)+Q的Q<192.9kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com