
【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl22H2O的流程如下:
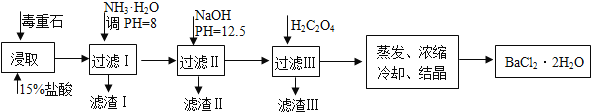
完成下列填空:
(1)毒重石用盐酸浸取前需充分研磨,目的是____________________。实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的____________________________。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)加入NH3H2O调节pH=8可除去_______(填离子符号),滤渣Ⅱ 中含__________(填化学式)。加入H2C2O4时应避免过量,原因是_________________________。
已知:Ksp(BaC2O4)=1.6×10﹣7,Ksp(CaC2O4)=2.3×10﹣9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
【答案】增大反应物的接触面积,增大反应速率 ac Fe3+ Mg(OH)2、Ca(OH)2 过量的H2C2O4会使Ba2+转化为BaC2O4沉淀,使BaCl2·2H2O的产量减少
【解析】
根据流程图分析各步反应及滤渣成分,根据溶液稀释的实验原理、沉淀的形成原理分析解答。
(1)化学反应的速率与反应物的接触面积有关,毒重石用盐酸浸取前需充分研磨,可以增大反应物的接触面积,增大反应速率;实验室用浓盐酸稀释配制稀盐酸,需用烧杯作为容器加定量的水稀释,同时用玻璃棒搅拌加速混合。由于所配制的是一定溶质质量分数的溶液,不是一定物质的量浓度的溶液,所以不必选用容量瓶,故答案为:增大反应物的接触面积,增大反应速率;ac;
(2)根据流程图和表中数据可知:Fe3+完全沉淀时的pH为3.2,加入氨水调pH为8,Fe3+完全沉淀,故滤渣Ⅰ为Fe(OH)3;由于Ca2+完全沉淀时的pH=13.9,Mg2+完全沉淀时的pH=11.1,当加入氢氧化钠调节pH=12.5时,Mg2+完全沉淀,Ca2+部分沉淀,故滤渣Ⅱ中含Mg(OH)2、Ca(OH)2。当加入H2C2O4时,结合BaC2O4,CaC2O4的沉淀溶解平衡常数值,得知更易形成CaC2O4沉淀,所以加入H2C2O4时应避免过量,防止CaC2O4沉淀完全后,过量的H2C2O4会使Ba2+转化为BaC2O4沉淀,使BaCl2·2H2O的产量减少,故答案为:Fe3+;Mg(OH)2、Ca(OH)2;过量的H2C2O4会使Ba2+转化为BaC2O4沉淀,使BaCl2·2H2O的产量减少。


 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:
【题目】有①氨水 ②NH4Cl溶液 ③Na2CO3溶液 ④NaHCO3溶液各25 mL,物质的量浓度均为0.1 mol/L,下列说法正确的是
A. 4种溶液pH的大小顺序:①>④>③>②
B. 溶液①、②等体积混合后pH > 7,则c(NH4+) < c(NH3·H2O)
C. 向溶液①、②中分别加入25 mL 0.1mol/L盐酸后,溶液中c(NH4+):①>②
D. 向溶液③、④中分别加入12.5 mL 0.1mol/L NaOH溶液后,两溶液中的离子种类相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是CO2生产甲醇的能量变化示意图.下列说法正确的是( )

A.E2_E1是该反应的热效应
B.E3_E1是该反应的热效应
C.该反应放热,在常温常压下就能进行
D.实现变废为宝,且有效控制温室效应
查看答案和解析>>
科目:高中化学 来源: 题型:
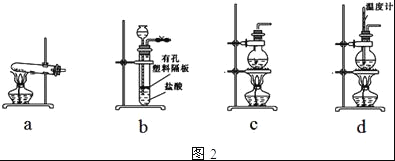
【题目】纯碱(Na2CO3)在生产生活中具有广泛的用途.如图1是实验室模拟制碱原理制取Na2CO3的流程图.
完成下列填空:
已知:粗盐中含有Ca2+、Mg2+、SO42﹣等杂质离子.
(1)精制除杂的步骤顺序是____→___→____→____→____ (填字母编号).
a 粗盐溶解 b 加入盐酸调pH c 加入Ba(OH)2溶液 d 加入Na2CO3溶液 e 过滤
(2)向饱和食盐水中先通入NH3,后通入CO2,理由是______.在滤液a中通入NH3和加入精盐的目的是______.
(3)请在图1流程图中添加两条物料循环的路线.____

(4)图2装置中常用于实验室制备CO2的是__(填字母编号);用c装置制备NH3,烧瓶内可加入的试剂是___(填试剂名称).
(5)一种天然碱晶体成分是aNa2CO3bNa2SO4cH2O,利用下列提供的试剂,设计测定Na2CO3质量分数的实验方案.请把实验方案补充完整:
供选择的试剂:稀H2SO4、BaCl2溶液、稀氨水、碱石灰、Ba(OH)2溶液
①______.
②______.
③______.
④计算天然碱晶体中含Na2CO3的质量分数.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个恒容的密闭容器中进行下列两个可逆反应:
甲:C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
乙:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
现有下列状态:①混合气体平均相对分子质量不再改变
②恒温时,气体压强不再改变 ③各气体组成浓度相等
④反应体系中温度保持不变 ⑤断裂氢氧键速率是断裂氢氢键速率的2倍 ⑥混合气体密度不变 ⑦单位时间内,消耗水蒸气质量与生成氢气质量比为9∶1
其中能表明甲、乙容器中反应都达到平衡状态的是( )
A. ①②⑤ B. ③④⑥ C. ⑥⑦ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图可设计成多种用途的电化学装置。下列分析正确的是
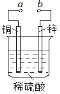
A.当a和b用导线连接时,溶液中的SO42-向铜片附近移动
B.当a和b用导线连接时,铜片上发生的反应为:2H++2e →H2↑
C.将a与电源正极相连可以保护锌片,叫牺牲阳极的阴极保护法
D.a和b用导线连接后,电路中通过0.02 mol电子时,产生0.02 mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一支充满水倒立于水槽中的大试管里依次通入a毫升二氧化氮,b毫升一氧化氮,c毫升氧气后,最终仍为一试管液体,则a、b、c之比可能为
A.6:2:3B.5:1:2C.6:1:2D.5:2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的水溶液显酸性,遇 FeCl3不显色,苯环上的一氯代物只有两种结构。试根据下图中各有机物的相互转化关系回答:
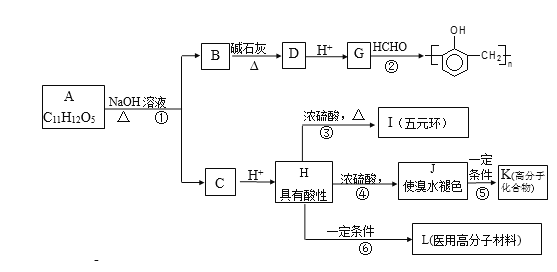
已知:① 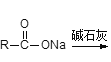 R-H;②
R-H;②![]() 。
。
完成下列填空:
(1)写出结构简式A___________________;L________________。
(2)上述物质中互为同分异构体的是_______________(填符号);
(3)上述变化中,属于缩聚反应的是_________;属于消去反应的是_______(均填反应编号)。
(4)物质B用盐酸酸化可得到产物W,写出一种既属于酚类、又属于酯类的的W的同分异构体______________________。
(5)反应③的产物除I之外,还有一些副产物,请写出其中2种类型不同的产物的结构简式____________________、____________________。
(6)设计一条从甲烷合成HCHO的合成路线。___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的热化学方程式。
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH=+64.39kJ/mol
2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.46kJ/mol
H2(g)+![]() O2(g)=H2O(l) ΔH=-285.84kJ/mol
O2(g)=H2O(l) ΔH=-285.84kJ/mol
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为_____________。
(2)在298K下,C、Al的单质各1mol完全燃烧,分别放出热量akJ和bkJ。又知一定条件下,Al能将C从CO2置换出来,写出此置换反应的热化学方程式_________________
(3)25℃,1.01×105Pa下,1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出表示硫燃烧热的热化学方程式___________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com