
【题目】有机物A的水溶液显酸性,遇 FeCl3不显色,苯环上的一氯代物只有两种结构。试根据下图中各有机物的相互转化关系回答:
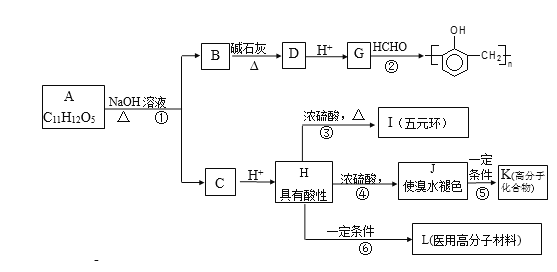
已知:① 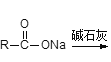 R-H;②
R-H;②![]() 。
。
完成下列填空:
(1)写出结构简式A___________________;L________________。
(2)上述物质中互为同分异构体的是_______________(填符号);
(3)上述变化中,属于缩聚反应的是_________;属于消去反应的是_______(均填反应编号)。
(4)物质B用盐酸酸化可得到产物W,写出一种既属于酚类、又属于酯类的的W的同分异构体______________________。
(5)反应③的产物除I之外,还有一些副产物,请写出其中2种类型不同的产物的结构简式____________________、____________________。
(6)设计一条从甲烷合成HCHO的合成路线。___________。
【答案】![]()
![]() I、J ②⑥ ④
I、J ②⑥ ④ ![]() CH2=CHCH2COOH; HOCH2CH2CH2COOCH2CH2CH2COOH CH4+Cl2
CH2=CHCH2COOH; HOCH2CH2CH2COOCH2CH2CH2COOH CH4+Cl2![]() CH2Cl2+2HCl、CH2Cl2+H2O
CH2Cl2+2HCl、CH2Cl2+H2O![]() HCHO+2HCl
HCHO+2HCl
【解析】
根据转化关系图知,G与甲醛得到酚醛树脂,可知G为![]() ,逆推可知D为
,逆推可知D为![]() ,有机物A的水溶液显酸性,遇FeC13溶液不显色,则A含有-COOH,不含酚羟基,苯环上的一氯代物只有两种,说明A的苯环上有2个不同的对位取代基,结合题目信息①中的脱羧反应,可知B的结构简式为
,有机物A的水溶液显酸性,遇FeC13溶液不显色,则A含有-COOH,不含酚羟基,苯环上的一氯代物只有两种,说明A的苯环上有2个不同的对位取代基,结合题目信息①中的脱羧反应,可知B的结构简式为![]() ,A中存在羧酸与酚形成的酯基,则C为羧酸纳盐,C酸化得到具有酸性,在浓硫酸、加热条件下可以得到J及I,是五元环状化合物,应是形成环酯,则H中还含有羟基,且羟基与羧基之间有3个碳原子,结合A的分子式可知,H为HOCH2CH2CH2COOH,逆推可知A为
,A中存在羧酸与酚形成的酯基,则C为羧酸纳盐,C酸化得到具有酸性,在浓硫酸、加热条件下可以得到J及I,是五元环状化合物,应是形成环酯,则H中还含有羟基,且羟基与羧基之间有3个碳原子,结合A的分子式可知,H为HOCH2CH2CH2COOH,逆推可知A为![]() ,C为HO(CH2)3COONa,顺推可知I为
,C为HO(CH2)3COONa,顺推可知I为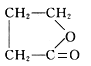 ,H通过酯化发生缩聚反应生成L为:
,H通过酯化发生缩聚反应生成L为:![]() ,H发生消去反应生成J为CH2=CHCH2COOH,J发生加聚反应生成K为
,H发生消去反应生成J为CH2=CHCH2COOH,J发生加聚反应生成K为 ,据此解答。
,据此解答。
(1)根据上述分析知,A为![]() ,L为
,L为![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(2)上述物质中I为 ,J为CH2=CHCH2COOH,二者分子式相同,结构不同,互为同分异构体,故答案为:I、J;
,J为CH2=CHCH2COOH,二者分子式相同,结构不同,互为同分异构体,故答案为:I、J;
(3)上述变化中,反应②⑥生成高聚物,且有水生成,属于缩聚反应,反应④属于消去反应,故答案为:②⑥;④;
(4)物质B用盐酸酸化可得到产物w,则W为![]() ,W的同分异构体中,既属于酚类,同时也属于酯类,侧链为-OH、-OOCH,有邻、间、对三种,其中一种同分异构体的结构简式为
,W的同分异构体中,既属于酚类,同时也属于酯类,侧链为-OH、-OOCH,有邻、间、对三种,其中一种同分异构体的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
(5)反应③的产物除I之外,还可能发生消去反应生成CH2=CHCH2COOH,也可以形成链状酯HOCH2CH2CH2COOCH2CH2CH2COOH等,故答案为:CH2=CHCH2COOH;HOCH2CH2CH2COOCH2CH2CH2COOH;
(6)上述反应中的HCHO可以用甲烷和必要的无机原料制备,有关反应的化学方程式为: CH4+Cl2![]() CH2Cl2+2HCl、CH2Cl2+H2O
CH2Cl2+2HCl、CH2Cl2+H2O![]() HCHO+2HCl,故答案为:CH4+Cl2
HCHO+2HCl,故答案为:CH4+Cl2![]() CH2Cl2+2HCl、CH2Cl2+H2O
CH2Cl2+2HCl、CH2Cl2+H2O![]() HCHO+2HCl。
HCHO+2HCl。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】某只含铁、氧两种元素的样品A,高温时与足量的CO充分反应,生成的气体被足量澄清石灰水吸收,测得沉淀的质量与原样品A质量相等。如果A中只含两种物质,则A中一定含有( )
A. FeO B. Fe2O3 C. Fe3O4 D. Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl22H2O的流程如下:
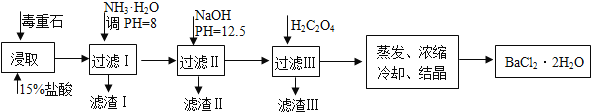
完成下列填空:
(1)毒重石用盐酸浸取前需充分研磨,目的是____________________。实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的____________________________。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)加入NH3H2O调节pH=8可除去_______(填离子符号),滤渣Ⅱ 中含__________(填化学式)。加入H2C2O4时应避免过量,原因是_________________________。
已知:Ksp(BaC2O4)=1.6×10﹣7,Ksp(CaC2O4)=2.3×10﹣9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向等物质的量浓度的Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS—、S2—)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
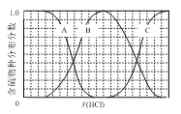
(1)含硫物种B表示__________(填离子符号)。
(2)在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为_____________(填选字母)。
a.c(Na+)= c(H2S)+c(HS—)+2c(S2—)
b.2c(Na+)=c(H2S)+c(HS—)+c(S2—)
c.c(Na+)=3[c(H2S)+c(HS—)+c(S2—)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组将纯净的SO2气体通入0.1molL﹣1的Ba(NO3)2溶液中,得到了BaSO4沉淀。为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2;
(1)验证假设一
该小组设计实验验证了假设一,请在下表空白处填写相关实验现象.
实验步骤 | 实验现象 | 结论 |
实验1:在盛有不含O2的25mL0.1molL﹣1BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | _______ | 假设一成立 |
实验2:在盛有不含O2的25mL0.1molL﹣1Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 | ________ |
为深入研究该反应,该小组还测得上述两个实验中溶液pH随通入SO2体积的变化曲线如图。实验1中溶液pH变小的原因是____________;V1时,实验2中溶液pH小于实验1的原因是__________。(用离子方程式表示)
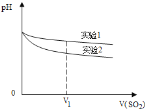
(2)验证假设二
请设计实验验证假设二,写出实验步骤、预期现象和结论:
实验步骤 | 实验现象 | 结论 |
__________________ | ______________ | 假设二成立 |
(3)若假设二成立,请预测:在相同条件下,分别用足量的O2和KNO3氧化相同的H2SO3溶液(溶液体积变化忽略不计),充分反应后两溶液的pH前者_____________(填“大于”或“小于”)后者,理由是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4.0mol PCl3和2.0mol Cl2充入体积不变的密闭容器中,一定条件下发生下述反应:PCl3(g)+Cl2(g) ![]() PCl5(g) 达到平衡后,PCl5为0.8 mol,如果此时再充入4.0mol PCl3和2.0mol Cl2,相同温度下再达到平衡时PCl5的物质的量是( )
PCl5(g) 达到平衡后,PCl5为0.8 mol,如果此时再充入4.0mol PCl3和2.0mol Cl2,相同温度下再达到平衡时PCl5的物质的量是( )
A.1.6molB.小于1.6molC.0.8molD.大于1.6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】形形色色的物质,构成了我们这个五彩缤纷的世界。世上万物,神奇莫测,常常超乎人们按“常理"的想象。学习物质结构和性质的知识,能使你想象的翅膀变得更加有力。
(1)基态Ga原子的核外电子排布式是[Ar]__,基态Ga原子核外电子占据最高能级的电子云轮廓图为___。
(2)HC≡CNa(乙炔钠)广泛用于有机合成,乙炔钠中C原子的杂化类型为__。乙炔钠中存在___(填字母)。
A.金属键 B.σ键 C.π键 D.氢键 E.配位键 F.离子键 G.范德华力
(3)NaN3是汽车安全气囊中的主要化学成分,其阴离子的立体构型为___。写出和该阴离子互为等电子体的一种分子的结构式___。
(4)配体中配位原子提供孤电子对的能力与元素的电负性有关,SCN-的结构式可以表示为[S=C=N]-或[S-C≡N]-,SCN-与Fe3+、Au+和Hg2+等离子能形成配离子,N、C、S的电负性依次为3.0、2.5和2.5。SCN-中提供孤电子对的原子可能是___。
(5)某离子晶体的晶胞结构如图所示。
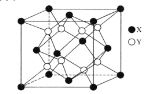
①晶体中在每个X周围与它最近且距离相等的X共有___个。
②设该晶体的摩尔质量为Mg·mol-1,晶胞的密度为ρg·cm-3,阿伏加德罗常数为NA,则晶体中两个最近的X间的距离为___cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较非金属性强弱:C_____Cl(填“>”,“<”,“=”)用一个化学方程式说明:________。
(2)Mg2C3可以和水作用生成丙炔,试写出Mg2C3的电子式________。
(3)氨基酸的熔点较一般分子晶体高,可能原因(不是氢键)是_______。(提示:从氨基酸的化学性质入手)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化钼(MoS2, 其中Mo的化合价为+4)被誉为“固体润滑剂之王”,利用低品质的辉钼矿(含MoS2、SiO2 以及CuFeS2等杂质)制备高纯二硫化钼的一种生产工艺如下:

回答下列问题:
(1)“酸浸”中加入氢氟酸是为了除去杂质SiO2,该反应的化学方程式为___________。
(2)在“氧化焙烧”过程中主要是将MoS2转化为MoO3,在该反应中氧化剂与还原剂的物质的量之比为________。
(3)若氧化焙烧产物产生烧结现象,在“氨浸”前还需进行粉碎处理,其目的是_________,“氨浸”后生成( NH4)2 MoO4反应的化学方程式为___________。
(4)向“氨浸”后的滤液中加入Na2S后,钼酸铵转化为硫代钼酸铵[(NH4)2MoS4],加入盐酸后,(NH4)2 MoS4与盐酸反应生成MoS3沉淀,沉淀反应的离子方程式为_________________。
(5)高纯MoS2中仍然会存在极微量的非整比晶体MoS2.8等杂质,在该杂质中为保持电中性,Mo元素有+4、+6两种价态,则MoS2中Mo4+所占Mo元素的物质的量分数 为__________。
为__________。
(6)钼酸钠晶体( Na2 MoO4 2H2O)是一种无公害型冷却水系统金属缓蚀剂,可以由MoS2制备。在制备过程中需加入Ba(OH)2固体除去SO42-,若溶液中c(MoO42-)=0.4 mol/L,c(SO42-)=0. 05 mol/L,常温下,当BaMoO4即将开始沉淀时,SO42-的去除率为____________ [忽略溶液体积变化。已知:259℃,Ksp( BaMoO4)=4.0×10-8 , Ksp(BaSO4)=1.1×10-10]。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com