
【题目】向等物质的量浓度的Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS—、S2—)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
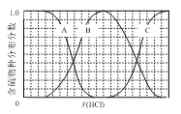
(1)含硫物种B表示__________(填离子符号)。
(2)在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为_____________(填选字母)。
a.c(Na+)= c(H2S)+c(HS—)+2c(S2—)
b.2c(Na+)=c(H2S)+c(HS—)+c(S2—)
c.c(Na+)=3[c(H2S)+c(HS—)+c(S2—)]
【答案】HS- c
【解析】
向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,盐酸和氢氧化钠先反应,然后和硫化钠反应,结合图1所示H2S、HS-、S2-的分布分数进行解答;NaHS的含量先增加后减少;根据物料守恒可求得滴加过程中,溶液中微粒浓度大小关系。
(1)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,盐酸和氢氧化钠先反应,然后和硫化钠反应,A表示含硫微粒浓度减小为S2-,B先增加后减少为HS-,C浓度一直在增加为H2S,故答案为:HS-;
(2)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,因体积相同,设Na2S、NaOH各为1mol,则n(Na)=3n(S),溶液中含硫的微粒为HS-、S2-、H2S,则c(Na+)=3[c(H2S)+c(HS-)+c(S2-)];溶液中存在电荷守恒得到c(Na+)=c(Cl-)+c(OH-)+c(HS-)+2c(S2-)-c(H+),故答案为:c。


科目:高中化学 来源: 题型:
【题目】下列有机物的同分异构体数目判断错误的是( )
选项 | 有机物 | 同分异构体数目 |
A | 分子式为 | 3 |
B | 分子式为 | 5 |
C | 分子式为 | 4 |
D | 分子式为 | 3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
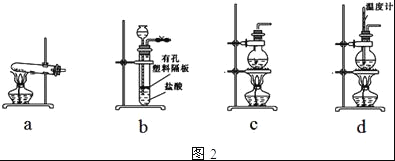
【题目】纯碱(Na2CO3)在生产生活中具有广泛的用途.如图1是实验室模拟制碱原理制取Na2CO3的流程图.
完成下列填空:
已知:粗盐中含有Ca2+、Mg2+、SO42﹣等杂质离子.
(1)精制除杂的步骤顺序是____→___→____→____→____ (填字母编号).
a 粗盐溶解 b 加入盐酸调pH c 加入Ba(OH)2溶液 d 加入Na2CO3溶液 e 过滤
(2)向饱和食盐水中先通入NH3,后通入CO2,理由是______.在滤液a中通入NH3和加入精盐的目的是______.
(3)请在图1流程图中添加两条物料循环的路线.____

(4)图2装置中常用于实验室制备CO2的是__(填字母编号);用c装置制备NH3,烧瓶内可加入的试剂是___(填试剂名称).
(5)一种天然碱晶体成分是aNa2CO3bNa2SO4cH2O,利用下列提供的试剂,设计测定Na2CO3质量分数的实验方案.请把实验方案补充完整:
供选择的试剂:稀H2SO4、BaCl2溶液、稀氨水、碱石灰、Ba(OH)2溶液
①______.
②______.
③______.
④计算天然碱晶体中含Na2CO3的质量分数.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图可设计成多种用途的电化学装置。下列分析正确的是
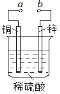
A.当a和b用导线连接时,溶液中的SO42-向铜片附近移动
B.当a和b用导线连接时,铜片上发生的反应为:2H++2e →H2↑
C.将a与电源正极相连可以保护锌片,叫牺牲阳极的阴极保护法
D.a和b用导线连接后,电路中通过0.02 mol电子时,产生0.02 mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一支充满水倒立于水槽中的大试管里依次通入a毫升二氧化氮,b毫升一氧化氮,c毫升氧气后,最终仍为一试管液体,则a、b、c之比可能为
A.6:2:3B.5:1:2C.6:1:2D.5:2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中,可逆反应:H2(g) + I2(g) ![]() 2HI (g)达到平衡的标志是( )
2HI (g)达到平衡的标志是( )
①H2、I2、HI的分子数之比为1∶1∶2
②混合气体的密度保持不变
③单位时间形成n mol H—H键,同时形成2n mol H—I键
④混合气体的颜色不再发生变化
⑤混合气体的平均相对分子质量不再发生变化
⑥容器压强不再发生变化
⑦H2的体积分数不再发生变化
A.①②④⑤B.③④C.③④⑦D.②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的水溶液显酸性,遇 FeCl3不显色,苯环上的一氯代物只有两种结构。试根据下图中各有机物的相互转化关系回答:
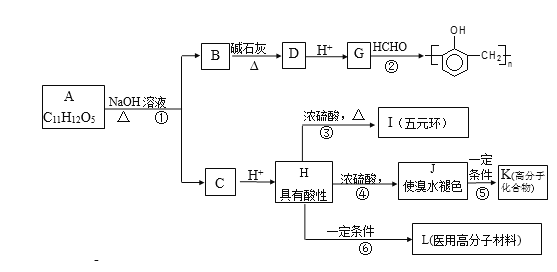
已知:① 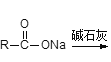 R-H;②
R-H;②![]() 。
。
完成下列填空:
(1)写出结构简式A___________________;L________________。
(2)上述物质中互为同分异构体的是_______________(填符号);
(3)上述变化中,属于缩聚反应的是_________;属于消去反应的是_______(均填反应编号)。
(4)物质B用盐酸酸化可得到产物W,写出一种既属于酚类、又属于酯类的的W的同分异构体______________________。
(5)反应③的产物除I之外,还有一些副产物,请写出其中2种类型不同的产物的结构简式____________________、____________________。
(6)设计一条从甲烷合成HCHO的合成路线。___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡鞣酸具有较广泛的抗菌作用,其结构简式如下图所示:

关于咖啡鞣酸的下列叙述正确的是( )
A.分子式为C16H13O9
B.1 mol咖啡鞣酸可与含8 mol NaOH的溶液反应
C.能使酸性KMnO4溶液褪色,说明分子结构中含有碳碳双键
D.与浓溴水能发生两种类型的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 (25 |
|
|
|
下列选项错误的是( )
A.CN + H2O + CO2 → HCN +HCO3﹣
B.2HCOOH + CO32﹣ → 2HCOO + H2O + CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com