
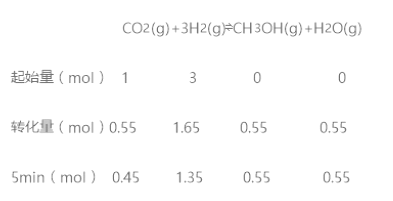
ЁОЬтФПЁПЬМбЛЗПЩвдЭЈЙ§ЯТСаЭООЖЃКCO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) ![]() +49.0kJЃЌдкШнЛ§ЮЊ2 LЕФУмБеШнЦїжаГфШы1 mol CO2КЭ3 mol H2ЃЌдкСНжжВЛЭЌЕФЪЕбщЬѕМўЯТНјааЗДгІЃЌВтЕУCH3OH(g)ЕФЮяжЪЕФСПЫцЪБМфБфЛЏЧщПіШчЭМЫљЪОЃК
+49.0kJЃЌдкШнЛ§ЮЊ2 LЕФУмБеШнЦїжаГфШы1 mol CO2КЭ3 mol H2ЃЌдкСНжжВЛЭЌЕФЪЕбщЬѕМўЯТНјааЗДгІЃЌВтЕУCH3OH(g)ЕФЮяжЪЕФСПЫцЪБМфБфЛЏЧщПіШчЭМЫљЪОЃК
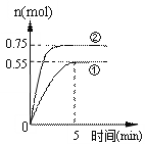
ЃЈ1ЃЉЧА5 minФкЪЕбщЂйЕФЦНОљЗДгІЫйТЪv(H2)=_____mol/(Lmin)ЁЃ
ЃЈ2ЃЉФмЫЕУїЩЯЪіЗДгІДяЕНЦНКтзДЬЌЕФЪЧ_________ЃЈЬюБрКХЃЉЁЃ
aЃЎЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПВЛЫцЪБМфБфЛЏЖјБфЛЏ
bЃЎЕЅЮЛЪБМфФкУПЯћКФ3 mol H2ЃЌЭЌЪБЩњГЩ1 mol H2O
cЃЎCO2ЕФЬхЛ§ЗжЪ§дкЛьКЯЦјЬхжаБЃГжВЛБф
dЃЎvФц(CO2) =3vе§(H2)
ЃЈ3ЃЉгыЂйЯрБШЃЌЂкНіИФБфвЛжжЗДгІЬѕМўЃЌЫљИФБфЕФЬѕМўЪЧ____________ЃЌХаЖЯЕФРэгЩ_______________________________________________________ЁЃ
ЃЈ4ЃЉдквЛЖЈЮТЖШЯТЃЌАб2.0 LCO2КЭ6.0 LH2ЭЈШывЛИіДјЛюШћЕФЬхЛ§ПЩБфЕФУмБеШнЦїжаЃЌЛюШћЕФвЛЖЫгыДѓЦјЯрЭЈЃЌЗДгІДяЕНЦНКтКѓЃЌВтЕУЛьКЯЦјЬхЮЊ7.0 LЁЃШєашПижЦЦНКтКѓЛьКЯЦјЬхЮЊ6.5 LЃЌдђПЩВЩШЁЕФДыЪЉЪЧ_____ЃЛгћЪЙЗДгІЕФKМѕаЁЃЌПЩвдВЩШЁЕФДыЪЉЪЧ_____ЁЃ
ЁОД№АИЁП0.165 ac діДѓбЙЧП вђЮЊгыЂйЯрБШЃЌЂкЕФЗДгІЫйТЪдіДѓЃЌЦНКте§ЯђвЦЖЏЃЌЗћКЯдіДѓбЙЧПЕФЧщПі НЕЮТ Щ§ЮТЁЃ
ЁОНтЮіЁП
ЃЈ1ЃЉИљОнШ§ЖЮЪНЃК
ДгЗДгІПЊЪМЕНЦНКт,ЧтЦјЕФЦНОљЗДгІЫйТЪv(H2)=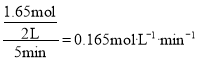 ЃЌЙЪД№АИЮЊЃК0.165ЃЛ
ЃЌЙЪД№АИЮЊЃК0.165ЃЛ
ЃЈ2ЃЉa. ИУЗДгІЧАКѓЦјЬхЗжзгЪ§ЗЂЩњИФБфЃЌЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПВЛЫцЪБМфБфЛЏЖјБфЛЏЃЌУїПЩФцЗДгІЕНДяЦНКтЃЌaе§ШЗЃЛ
b. ЕЅЮЛЪБМфФкУПЯћКФ3molH2ЃЌЭЌЪБЩњГЩ1molH2OЃЌЖМБэЪОе§ЗДгІЫйТЪЃЌВЛФмЫЕУїПЩФцЗДгІЕНДяЦНКтЃЌbДэЮѓЃЛ
c. CO2ЕФЬхЛ§ЗжЪ§дкЛьКЯЦјЬхжаБЃГжВЛБфЃЌЫЕУїПЩФцЗДгІЕНДяЦНКтЃЌcе§ШЗЃЛ
d. ВЛЪЧ vФц(CO2) =3vе§(H2)ЃЌЪЧ3vФц(CO2)=vе§(H2)ЃЌИУЪНзгБэЪОЕФЖМЪЧЗДгІЮяЕФЫйТЪЃЌЧвЕШгкМЦСПЪ§жЎБШЃЌдђЗДгІВЛЙмДяУЛДяЕНЦНКтзДЬЌЖМДцдкИУЕШЪНЙиЯЕЫЕУїЕНДяЦНКтЃЌdДэЮѓЃЛЙЪД№АИЮЊЃКacЃЛ
ЃЈ3ЃЉЂкБШЂйИќдчДяЕНЦНКтЃЌЧвгыЂйЯрБШЃЌДяЕНЦНКтЪБЃЌМзДМЕФХЈЖШНЯДѓЃЌЫЕУїгыЂйЯрБШЃЌЂкЕФЦНКте§ЯђвЦЖЏЃЌдђИФБфЕФЬѕМўЪЧЃКдібЙЃЛдвђЪЧЃКвђЮЊгыЂйЯрБШЃЌЂкЕФЗДгІЫйТЪдіДѓЃЌЦНКте§ЯђвЦЖЏЃЌЗћКЯдіДѓбЙЧПЕФЧщПіЃЌВЛФмЪЧЩ§ЮТЃЌЩ§ЮТЦНКтФцЯђвЦЖЏЃЌгыЭМЯёВЛЗћЃЌЙЪД№АИЮЊЃКдіДѓбЙЧПЃЛвђЮЊгыЂйЯрБШЃЌЂкЕФЗДгІЫйТЪдіДѓЃЌЦНКте§ЯђвЦЖЏЃЌЗћКЯдіДѓбЙЧПЕФЧщПіЁЃ
ЃЈ4ЃЉCO2(g)+3H2(g)CH3OH(g)+H2O(g) ![]() +49.0kJЃЌИУЗДгІЮЊе§ЗДгІЗХШШЕФЗДгІЃЌЧвЗДгІЧАКѓЬхЛ§МѕаЁЕФЗДгІЃЌЗДгІДяЕНЦНКтКѓЃЌВтЕУЛьКЯЦјЬхЮЊ7.0 LЃЌШєашПижЦЦНКтКѓЛьКЯЦјЬхЮЊ6.5 LЃЌдђПЩВЩШЁЕФДыЪЉЪЧНЕЮТЃЛгћЪЙЗДгІЕФKМѕаЁЃЌМДЦНКтФцЯђвЦЖЏЃЌдђПЩвдВЩШЁЕФДыЪЉЪЧЩ§ЮТЃЌЙЪД№АИЮЊЃКНЕЮТЃЛЩ§ЮТЁЃ
+49.0kJЃЌИУЗДгІЮЊе§ЗДгІЗХШШЕФЗДгІЃЌЧвЗДгІЧАКѓЬхЛ§МѕаЁЕФЗДгІЃЌЗДгІДяЕНЦНКтКѓЃЌВтЕУЛьКЯЦјЬхЮЊ7.0 LЃЌШєашПижЦЦНКтКѓЛьКЯЦјЬхЮЊ6.5 LЃЌдђПЩВЩШЁЕФДыЪЉЪЧНЕЮТЃЛгћЪЙЗДгІЕФKМѕаЁЃЌМДЦНКтФцЯђвЦЖЏЃЌдђПЩвдВЩШЁЕФДыЪЉЪЧЩ§ЮТЃЌЙЪД№АИЮЊЃКНЕЮТЃЛЩ§ЮТЁЃ


 ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ
ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПМзДМжЪзгНЛЛЛФЄШМСЯЕчГижаНЋМзДМеєЦјзЊЛЏЮЊЧтЦјЕФСНжжЗДгІдРэЪЧЃК
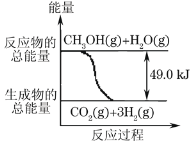
ЂйCH3OH(g)+H2O(g)ЁњCO2(g)+3H2(g) -49.0kJ
ЂкCH3OH(g)+![]() O2(g)ЁњCO2(g)+2H2(g)+192.9kJ
O2(g)ЁњCO2(g)+2H2(g)+192.9kJ
ЯТСаЫЕЗЈе§ШЗЕФЪЧ( )
A.1molCH3OHЭъШЋШМЩеЗХШШ192.9kJ
B.ЗДгІЂйжаЕФФмСПБфЛЏШчЭМЫљЪО
C.CH3OHзЊБфГЩH2ЕФЙ§ГЬвЛЖЈвЊЮќЪеФмСП
D.ИљОнЂкЭЦжЊЗДгІЃКCH3OH(l)+![]() O2(g)ЁњCO2(g)+2H2(g)+QЕФQ<192.9kJ
O2(g)ЁњCO2(g)+2H2(g)+QЕФQ<192.9kJ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТУцЪЧЩњВњЩњЛюжаЕФГЃМћгаЛњЮяЕФЗжзгЪНЁЂНсЙЙЪНЁЂНсЙЙМђЪНЛђУћГЦгаЙиЫЕЗЈе§ШЗЕФЪЧ
Ђй![]() Ђк
Ђк![]() Ђл
Ђл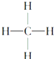 Ђм
Ђм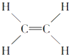 ЂнCH3CH2OH
ЂнCH3CH2OH
ЂоC6H12O6ЂпCH3COOH ЂргВжЌЫсИЪгЭѕЅ ЂсЕААзжЪ ЂтОлввЯЉ
A. ФмИњфхЕФЫФТШЛЏЬМШмвКЗЂЩњМгГЩЗДгІВЂЪЙжЎЭЪЩЋЕФгаЂйЂкЂмЂт
B. ЭЖШыФЦФмВњЩњH2ЕФЪЧЂнЂпЂрЂс
C. ЪєгкИпЗжзгВФСЯЕФЪЧЂрЂсЂт
D. КЌЬМСПзюИпЁЂгаЖОЁЂГЃЮТЯТЮЊвКЬхЧвЕуШМЪБгаХЈбЬЕФЪЧЂй
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгаЛњЛЏКЯЮяGЪЧКЯГЩЮЌЩњЫиРрвЉЮяЕФжаМфЬхЃЌЦфНсЙЙМђЪНШчЭМ1ЫљЪОЃЌGЕФКЯГЩТЗЯпШчЭМ2ЫљЪОЃК
ЦфжаAЁЋFЗжБ№ДњБэвЛжжгаЛњЛЏКЯЮяЃЌКЯГЩТЗЯпжаВПЗжВњЮяМАЗДгІЬѕМўвбТдШЅ
вбжЊЃК-CHO+
ЧыЛиД№ЯТСаЮЪЬтЃК
(1)GЕФЗжзгЪНЪЧ__ЃЌGжаЙйФмЭХЕФУћГЦЪЧ__ЃЛ
(2)ЕкЂйВНЗДгІЕФЛЏбЇЗНГЬЪНЪЧ__ЃЛ
(3)BЕФУћГЦ(ЯЕЭГУќУћ)ЪЧ__ЃЛ
(4)ЕкЂкЁЋЂоВНЗДгІжаЪєгкШЁДњЗДгІЕФга__(ЬюВНжшБрКХ)ЃЛ
(5)ЕкЂмВНЗДгІЕФЛЏбЇЗНГЬЪНЪЧ________ЃЛ
(6)аДГіЭЌЪБТњзуЯТСаЬѕМўЕФEЕФЫљгаЭЌЗжвьЙЙЬхЕФНсЙЙМђЪН__ЃЌЂйжЛКЌвЛжжЙйФмЭХЃЛЂкСДзДНсЙЙЧвЮоЉOЉOЉЃЛЂлКЫДХЙВеёЧтЦзжЛга2жжЗхЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЯЁШмвКжаКЌгаЕШЮяжЪЕФСПЕФZnSO4ЁЂFe2(SO4)3ЁЂH2SO4ЁЂCuSO4ЃЌЯђЦфжаж№НЅМгШыЬњЗлЁЃЯТСаИїЭМБэЪОШмвКжаFe2ЃЋЕФЮяжЪЕФСПКЭМгШыЬњЗлЕФЮяжЪЕФСПжЎМфЕФЙиЯЕЃЌЦфжаПЩФме§ШЗЕФЪЧЃЈ ЃЉ
A.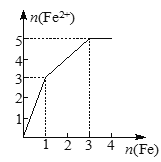 B.
B.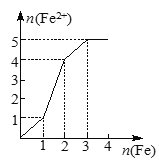
C. D.
D.
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪвЮТЯТЃЌ2H2(g)+O2(g)![]() 2H2O(l)+566kJЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧ
2H2O(l)+566kJЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧ
A.H2![]() H+HЕФЙ§ГЬашвЊЮќШШ
H+HЕФЙ§ГЬашвЊЮќШШ
B.ШєЩњГЩ2molЫЎеєЦјЃЌдђЗХГіЕФШШСПДѓгк566kJ
C.2gЧтЦјЭъШЋШМЩеЩњГЩвКЬЌЫЎЫљЪЭЗХЕФФмСПЮЊ283kJ
D.2molЧтЦјгы1molбѕЦјЕФФмСПжЎКЭДѓгк2molвКЬЌЫЎЕФФмСП
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПХаЖЯЯТСаИїЮяжЪЫљЪєЕФРрБ№ЃЌВЂАбЯргІЕФађКХЬюШыБэжаЁЃ
Ђй![]() Ђк
Ђк![]() Ђл
Ђл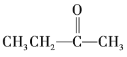 Ђм
Ђм Ђн
Ђн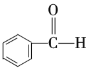 Ђо
Ђо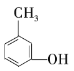 Ђп
Ђп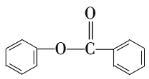 Ђр
Ђр![]() Ђс
Ђс![]() Ђт
Ђт![]()
![]()
![]()
ЗжРр | ЗМЯуЬў | ТБДњЬў | ДМ | Зг | ШЉ | ЭЊ | єШЫс | ѕЅ |
ЮяжЪ | ________ | _________ | ________ | _________ | _________ | ________ | p>________ | ________ |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊNaHSO3ШмвКЯдЫсадЃЌШмвКжаДцдквдЯТЦНКтЃКHSO3Ѓ+ H2O![]() H2SO3 + OHЃЂй HSO3Ѓ
H2SO3 + OHЃЂй HSO3Ѓ![]() H+ + SO32Ѓ ЂкЃЌЯђ0.1mol/LЕФNaHSO3ШмвКжаЗжБ№МгШывдЯТЮяжЪЃЌЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧ
H+ + SO32Ѓ ЂкЃЌЯђ0.1mol/LЕФNaHSO3ШмвКжаЗжБ№МгШывдЯТЮяжЪЃЌЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧ
A.МгШыЩйСПН№ЪєNaЃЌЦНКтЂйзѓвЦЃЌЦНКтЂкгввЦЃЌШмвКжаc(HSO3-)діДѓ
B.МгШыЩйСПNa2SO3ЙЬЬхЃЌдђc(H+) + c(Na+) = c(HSO3Ѓ) + c(OHЃ) +![]() c(SO32Ѓ)
c(SO32Ѓ)
C.МгШыЩйСПNaOHШмвКЃЌ![]() ЁЂ
ЁЂ![]() ЕФжЕОљдіДѓ
ЕФжЕОљдіДѓ
D.МгШыАБЫЎжСжаадЃЌдђc(Na+) = c(SO32-)+c(HSO3- )+ c(H2SO3)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮоЫЎЫФТШЛЏЮ§ЃЈSnCl4ЃЉГЃгУзїгаЛњКЯГЩЕФТШЛЏДпЛЏМСЃЌЪЕбщЪвПЩгУЁАвчСїЗЈЁБСЌајжЦБИЁЃSnCl4взЛгЗЂЃЌМЋвзЗЂЩњЫЎНтЃЌCl2МЋвзШмгкSnCl4ЁЃжЦБИдРэгыЪЕбщзАжУШчЭМЫљЪОЃК
Sn(s)+2Cl2(g)=SnCl4(l) ІЄH=ЈC511kJmolЃ1

ПЩФмгУЕНЕФгаЙиЪ§ОнШчЯТЃК
ЮяжЪ | Sn | SnCl4 | CuCl2 |
ШлЕу/Ёц | 232 | -33 | 620 |
ЗаЕу/Ёц | 2260 | 114 | 993 |
жЦБИЙ§ГЬжаЃЌЮ§СЃж№НЅБЛЯћКФЃЌаыЬсРЯ№НКШћМАЪБЯђЗДгІЦїжаВЙМгЮ§СЃЁЃЕБSnCl4вКУцЩ§жСВрПкИпЖШЪБЃЌвКЬЌВњЮяОВрЙмСїШыНгЪеЦПЁЃЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉSnдкжмЦкБэжаЕФЮЛжУЮЊ_______________
ЃЈ2ЃЉaЙмЕФзїгУЪЧ_______________ЃЌAжаЗДгІЕФРызгЗНГЬЪНЪЧ______________ЁЃ
ЃЈ3ЃЉзАжУDЕФзїгУЪЧ________________ЃЌзАжУEжаРфШДЫЎЕФзїгУЪЧ___________ЁЃ
ЃЈ4ЃЉМгШШSnСЃжЎЧАвЊЯШШУТШЦјГфТњећЬззАжУЃЌЦфФПЕФЪЧ___________________ЁЃ
ЃЈ5ЃЉЮ§СЃжаКЌЭдгжЪжТEжаВњЩњCuCl2ЃЌЕЋВЛгАЯьFжаВњЦЗЕФДПЖШЃЌдвђЪЧ________ЁЃЪЕбщЫљЕУSnCl4вђШмНтСЫCl2ЖјТдЯдЛЦЩЋЃЌЬсДПSnCl4ЕФЗНЗЈЪЧ____(ЬюађКХ)ЁЃ
a.гУNaOHШмвКЯДЕгдйеєСѓ b.Щ§ЛЊ c.еєСѓ d.Й§ТЫ
ЃЈ6ЃЉЮВЦјДІРэЪБЃЌПЩбЁгУЕФзАжУЪЧ________ЃЈЬюађКХЃЉЁЃ

ЃЈ7ЃЉSnCl4дкПеЦјжагыЫЎеєЦјЗДгІГ§ЩњГЩАзЩЋSnO2ЁЄxH2OЙЬЬхЃЌЛЙПЩвдПДЕНДѓСПАзЮэЃЌЛЏбЇЗНГЬЪНЮЊ___________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com